题目内容
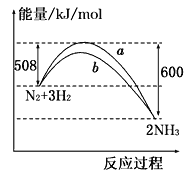
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
【答案】B
【解析】试题分析:A、水的电离是吸热过程,升高温度,促进电离,Kw增大,pH降低,故错误;B、水中加入盐酸,c(H+)增大,Kw只受温度的影响,温度不变,Kw不变,故错误;C、加入NaOH,c(OH-)增大,水的电离被抑制,但溶液中c(OH-)增大,故错误;D、AlCl3属于强酸弱碱盐,发生水解,促进水的电离,c(OH-)减小,故错误。

练习册系列答案
相关题目
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:

(1)M为电源的__________极(填“正”或“负”)。
(2)写出甲烧杯中反应的化学方程式____________________。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的_________(填“M”或“N”)极。

(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料。该设想中负极的电极反应式为 __________________。