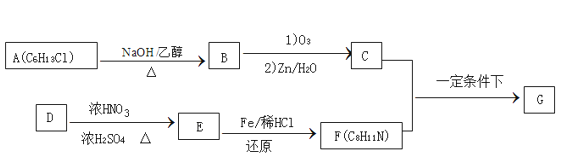
题目内容
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
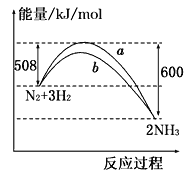
A. 该反应的热化学方程式为:N2 + 3H2 ![]() 2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
C. b曲线是加入催化剂时的能量变化曲线
D. 加入催化剂, 该化学反应的ΔH不改变
【答案】D
【解析】A.由图可知,反应物总能量大于生成物总能量,为放热反应,且焓变△H=508kJ/mol-600kJ/mol=-92 kJ/mol,则该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H=-92 kJ/mol,A错误;B.合成氨为可逆反应,不能完全转化,则温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量小于92kJ,B错误;C.催化剂可降低反应所需的活化能,则a曲线是加入催化剂时的能量变化曲线,C错误;D.催化剂不改变反应的始终态,则加入催化剂,该化学反应的反应热不改变,D正确;答案选D。
2NH3(g)△H=-92 kJ/mol,A错误;B.合成氨为可逆反应,不能完全转化,则温度、体积一定的条件下,通入1molN2和3molH2反应后放出的热量小于92kJ,B错误;C.催化剂可降低反应所需的活化能,则a曲线是加入催化剂时的能量变化曲线,C错误;D.催化剂不改变反应的始终态,则加入催化剂,该化学反应的反应热不改变,D正确;答案选D。

练习册系列答案
相关题目