题目内容
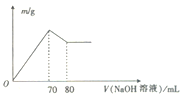
【题目】某同学设计如下实验方案,以分离混合溶液中的AlCl3和FeCl2。
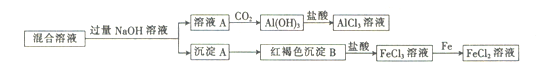
(1)沉淀A的化学式为________________ 。
(2)写出AlCl3溶液与过量NaOH溶液反应的离子方程式:___________________________。
(3)写出沉淀A转化为沉淀B反应的化学方程式:___________________。
(4)写出检验溶液A中是否含有Fe2+时的方法:________________________________。
【答案】 Fe(OH)2 Al3++4OH-=AlO2-+2H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量溶液A 于试管中,加入过量盐酸酸化后,先滴入几滴KSCN溶液,无明显现象,再滴入适量氯水,若溶液变红,则说明含有Fe2+,否则不含(其他合理答案均可)
【解析】加入过量的氢氧化钠溶液时铝离子转化为偏铝酸根离子,亚铁离子转化为氢氧化亚铁沉淀,A是氢氧化亚铁,在空气中被氧化转化为氢氧化铁,即B是氢氧化铁。氢氧化铁和盐酸反应生成氯化铁和水,投入铁粉生成氯化亚铁。溶液A中含有过量的氢氧化钠和生成的偏铝酸钠,通入CO2生成氢氧化铝沉淀,氢氧化铝和盐酸反应生成氯化铝和水。
(1)根据以上分析可知沉淀A的化学式为Fe(OH)2。(2)AlCl3溶液与过量NaOH溶液反应的离子方程式为Al3++4OH-=AlO2-+2H2O。(3)沉淀A转化为沉淀B反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(4)亚铁离子具有还原性,检验溶液A中是否含有Fe2+时的方法为:取少量溶液A于试管中,加入过量盐酸酸化后,先滴入几滴KSCN溶液,无明显现象,再滴入适量氯水,若溶液变红,则说明含有Fe2+,否则不含。

【题目】(1)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1 kJ、Q2 kJ、Q3 kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值______(填偏大、偏小、无影响)。
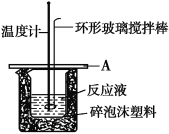
(3)实验室用50 mL 0.50 molL1盐酸、50 mL 0.55 molL1 NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
【题目】下列反应中产生气泡速率最快的是( )
选项 | 温度 | 浓度 | 外加物质 |
A | 25 ℃ | 2 mL 5% H2O2 | 2滴0.1 mol·L-1 FeCl3 |
B | 35 ℃ | 2 mL 8% H2O2 | 2滴0.1 mol·L-1CuCl2 |
C | 25 ℃ | 2 mL 5% H2O2 | MnO2粉末 |
D | 35 ℃ | 2 mL 8% H2O2 | MnO2粉末 |
A. A B. B C. C D. D