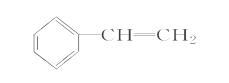
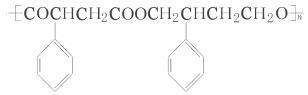
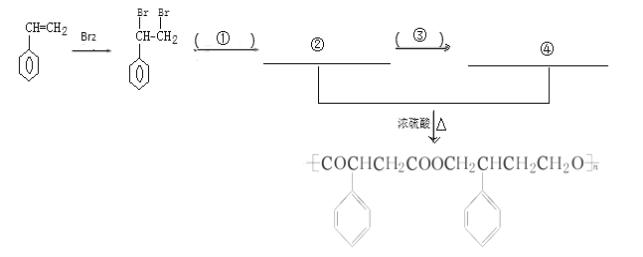
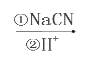题目内容
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
【答案】
(1)5H2O2+2MnO4-+6H+===5O2↑+2Mn2++8H2O
(2)KMnO4 氧元素 6.02×1023
(3)2H2O2![]() 2H2O+O2↑ 3.01×1023
2H2O+O2↑ 3.01×1023
【解析】
试题分析:在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:①氧化反应:H2O2-2e-═2H++O2↑,②还原反应:MnO4-+5e-+8H+═Mn2++4H2O,①×5+②×2得到:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(1)该氧化还原反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(2)依据反应中化合价降低的元素是锰元素,从+7价降到+2价,所以氧化剂是KMnO4,过氧化氢中氧元素化合价从-1价升高到0价,做还原剂被氧化,若有0.5mol H2O2参加此反应,根据离子方程式5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;可知转移电子数1mol,转移电子个数为6.02×1023;故答案为:KMnO4,氧,6.02×1023;
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2![]() 2H2O+O2↑; H2O2发生分解,氧元素化合价从-1价变化为0价和-2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023;故答案为:2H2O2
2H2O+O2↑; H2O2发生分解,氧元素化合价从-1价变化为0价和-2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023;故答案为:2H2O2![]() 2H2O+O2↑; 3.01×1023。
2H2O+O2↑; 3.01×1023。

 阅读快车系列答案
阅读快车系列答案