题目内容
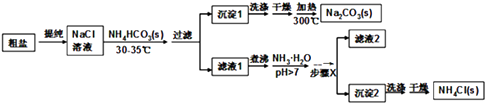
【题目】五种短周期主族元素的部分信息如下表所示:
(1)E在元素周期表中的位置是____________________。
(2)在BDC溶液中滴加酚酞溶液,溶液先变红后褪色,原因是__________________(用离子方程式表示)。
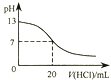
(3)25℃时,pH均为10的BCA溶液和B2E溶液中,水电离出的c(OH-)之比为____________。
(4)下列事实中,能说明D的非金属性比E强的是________ (填字母)。
a.D的简单氢化物比E的稳定 b.AD的酸性比A2E的强
c.D的单质的沸点低于E的单质 d.D2与A2E能发生置换反应
(5)500℃时,向容积为1L的恒容密闭容器中充入2mol EC3气体,在催化剂作用下发生反应,经过10min恰好达到平衡,测得平衡浓度c(C2)=0.75mol·L-1。
①反应从开始到平衡时的平均反应速率v(EC2)=____________。
②EC3的平衡转化率为____________。
③其他条件不变,再向容器中充入少量EC3气体,则EC3的平衡转化率会________ (填“增大”“减小”或“不变”)。
(6)在B2E2C3溶液中滴加BAEC4溶液,会析出黄色沉淀并逸出刺激性气体,反应的离子方程式为____________________________________。
【答案】 第三周期ⅥA族 ClO+H2O![]() HClO+OH 1∶106(或106) ad 0.15 mol·L1·min1 75% 减小 S2O32+2H===S↓+SO2↑+H2O
HClO+OH 1∶106(或106) ad 0.15 mol·L1·min1 75% 减小 S2O32+2H===S↓+SO2↑+H2O
【解析】A和B化合价均为+1价,应为IA族,B焰色为黄色,得B为钠元素,A为氢元素,C和E,C只有-2价,为氧元素,E有-2和+6价,为硫元素;D有-1和+7价,结合原子半径为D小于E,D为氯元素。
(1)E为硫元素,在元素周期表中的位置是第三周期ⅥA族;(2)在NaClO溶液中滴加酚酞溶液,溶液先变红后褪色,原因是ClO+H2O![]() HClO+OH(用离子方程式表示)。(3)25℃时,pH均为10的NaOH溶液水电离出的c(OH-)=10-10mol·L-1和Na2S溶液中水电离出的c(OH-)=10-4mol·L-1,水电离出的c(OH-)之比为10-10:10-4=1∶106。(4)a.同一周期,气态氢化物越稳定,元素的非金属越强,Cl的简单氢化物比S的稳定, 能说明Cl的非金属性比S强,故a正确;b.比较元素的非金属性应用元素对应最高价氧化物的水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,例如盐酸的酸性比氢硫酸强,故b错误;c.D的单质的沸点低于E的单质 ,是物理性质,与非金属性无关,所以无法说明非金属性的强弱,故c错误;d.将Cl2通入氢硫酸中可置换出S,说明氯气的氧化性比S强,单质的氧化性越强,非金属性越强,所以能证明Cl的非金属性比S的强,故d正确;故选ad。(5)500℃时,
HClO+OH(用离子方程式表示)。(3)25℃时,pH均为10的NaOH溶液水电离出的c(OH-)=10-10mol·L-1和Na2S溶液中水电离出的c(OH-)=10-4mol·L-1,水电离出的c(OH-)之比为10-10:10-4=1∶106。(4)a.同一周期,气态氢化物越稳定,元素的非金属越强,Cl的简单氢化物比S的稳定, 能说明Cl的非金属性比S强,故a正确;b.比较元素的非金属性应用元素对应最高价氧化物的水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,例如盐酸的酸性比氢硫酸强,故b错误;c.D的单质的沸点低于E的单质 ,是物理性质,与非金属性无关,所以无法说明非金属性的强弱,故c错误;d.将Cl2通入氢硫酸中可置换出S,说明氯气的氧化性比S强,单质的氧化性越强,非金属性越强,所以能证明Cl的非金属性比S的强,故d正确;故选ad。(5)500℃时,
① 2SO3 ![]() 2SO2 + O2
2SO2 + O2
c始 2
c变 1.5 1.5 0.75
c平 0.5 1.5 0.75
反应从开始到平衡时的平均反应速率v(SO2)= ![]() 0.15 mol·L1·min1。②SO3的平衡转化率为
0.15 mol·L1·min1。②SO3的平衡转化率为![]() = 75% 。③其他条件不变,再向容器中充入少量SO3气体,相当于加压,平衡逆向移动,则SO3的平衡转化率会减小。(6)在Na2S2O3溶液中滴加NaHSO4溶液,会析出黄色沉淀并逸出刺激性气体,反应的离子方程式为S2O32+2H===S↓+SO2↑+H2O。
= 75% 。③其他条件不变,再向容器中充入少量SO3气体,相当于加压,平衡逆向移动,则SO3的平衡转化率会减小。(6)在Na2S2O3溶液中滴加NaHSO4溶液,会析出黄色沉淀并逸出刺激性气体,反应的离子方程式为S2O32+2H===S↓+SO2↑+H2O。

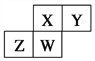
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。