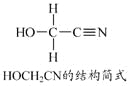
题目内容
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
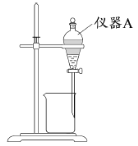
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快酸溶速率 避免制备MgCO3时消耗更多的碱
(2)H2O2+2Fe2++2H+===2Fe3++2H2O (3)①分液漏斗 ②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向
上层清液中滴加Na2CO3溶液,若无沉淀生成
【解析】
试题分析:(1)加热可以加快反应速率;如果硫酸过多,则需要消耗更多的碱液中和硫酸,从而造成生产成本增加,因此所加H2SO4不宜过量太多。
(2)溶液中含有亚铁离子,双氧水具有强氧化性,能把亚铁离子氧化为铁离子,因此加入H2O2氧化时发生发应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①实验装置图中仪器A的名称为分液漏斗。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,充分振荡、静置、分液,并重复多次。
(4)根据氢氧化镁和氢氧化铝沉淀的pH可知,滴加氨水的同时必须控制溶液的pH不能超过8.5,且也不能低于5.0,所以边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。

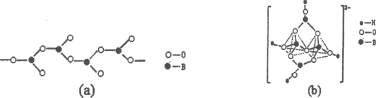
【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
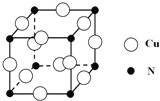
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
, ![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
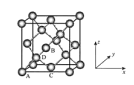
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a="565.76" pm,其密度为__________g·cm-3(列出计算式即可)。
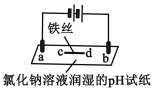
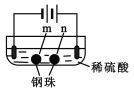
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
【题目】化学与我们的生活息息相关。下列说法不正确的是
A.玻璃、水晶和陶瓷都是传统硅酸盐材料
B.可溶性铝盐和铁盐可用作净水剂
C.SO2和NO都能形成酸雨而破坏环境
D.CO2和CH4都是引起温室效应的气体
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
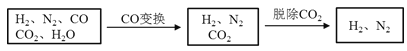
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
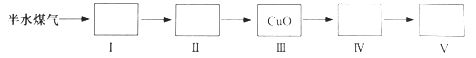
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。