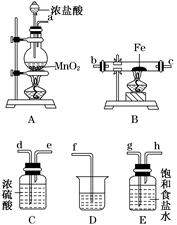
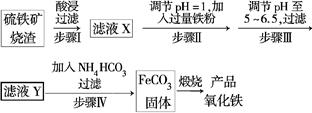
题目内容
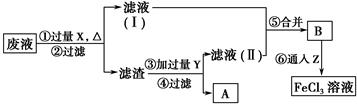
根据下列框图分析,下列说法正确的是( )
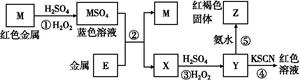

| A.E3+的氧化性比M2+的氧化性弱 |
| B.在反应①中硫酸既表现了酸性、又表现了氧化性 |
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓ E(SCN)3↓ |
| D.在③反应中若不加稀硫酸可能看到红褐色沉淀 |
D
M是红色金属,则可以确定是金属铜,在H2O2作用下与H2SO4反应生成CuSO4,Y遇到KSCN出现红色,Y中有Fe3+,则金属E是铁,X是FeSO4,经③步反应氧化为Fe2(SO4)3,与氨水反应得到红褐色的Fe(OH)3。Fe3+的氧化性比Cu2+的氧化性强,A错;在反应①中硫酸只表现了酸性,H2O2表现了氧化性,B错;SCN-与Fe3+反应生成的产物是可溶于水的配离子,C错;反应③为:2Fe2++H2O2+2H+ 2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
 2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。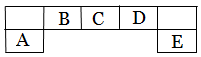
 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。