题目内容
Fe元素是地壳中最丰富的元素之一,在金属中含量仅次于铝,铁及其化合物在生活生产中有广泛应用。请回答下列问题。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
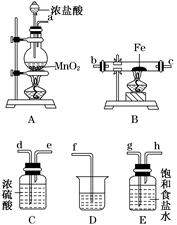
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO
 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。

请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
(1)8
(2)因酸性废液中,H+将会抑制Fe3+的水解,无法得到Fe(OH)3胶体,故不能够吸附悬浮物
(3)①E C B ②干燥Cl2,防止FeCl3的水解而产生Fe2O3杂质 ③产生棕(红)色的烟 硫氰化钾
(2)因酸性废液中,H+将会抑制Fe3+的水解,无法得到Fe(OH)3胶体,故不能够吸附悬浮物
(3)①E C B ②干燥Cl2,防止FeCl3的水解而产生Fe2O3杂质 ③产生棕(红)色的烟 硫氰化钾
(1)1 mol Fe3O4参加反应消耗4 mol CO, 1 mol CO转变为CO2失去2 mol电子,故转移电子的物质的量是8 mol。(2)Fe3+的水解受到H+的抑制作用,故得不到Fe(OH)3胶体。(3)根据2Fe+3Cl2 2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
 2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
练习册系列答案
相关题目
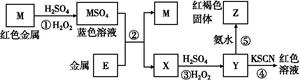
 E(SCN)3↓
E(SCN)3↓