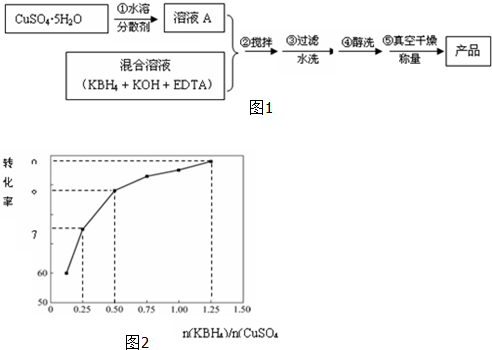
题目内容
15.已知Na2S203在中性或碱性条件下稳定,在酸性条件下会变黄,用离子方程式表示变黄的原因:S2032-+2H+=S↓+SO2↑+H2O.分析 Na2S203在酸性条件下反应生成硫、二氧化硫和水而变黄,据此解答.
解答 解:Na2S203在酸性条件下反应生成硫、二氧化硫和水,离子方程式:S2032-+2H+=S↓+SO2↑+H2O,
故答案为:S2032-+2H+=S↓+SO2↑+H2O.
点评 本题考查了离子方程式的书写,明确硫代硫酸钠的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
5.在0.5mol Na2SO4中,含有的氧原子个数约为( )
| A. | 1.204×1024 | B. | 0.5 | C. | 6.02×1023 | D. | 3.01×1023 |
10.将200mL 0.3mol•L-1的NaOH溶液和100mL 0.6mol•L-1的NaOH溶液混合,如果不考虑混合时体积的变化,所得溶液中NaOH的物质的量浓度(单位:mol•L-1)为( )
| A. | 0.3 | B. | 0.4 | C. | 0.45 | D. | 0.6 |
20.某种抗病毒药物M中含有C、H、O、N等元素,已知0.125mol药物M的质量是22.5g,则药物M的摩尔质量是( )
| A. | 225g•mol-1 | B. | 180g•mol-1 | C. | 90g•mol-1 | D. | 45g•mol-1 |
7.NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1mol/L醋酸钠(CH3COONa)溶液中CH3COO-数目小于NA | |
| B. | 在标准状况下,11.2L氨气溶于水配制成1L溶液,NH4+离子数目为0.5NA | |
| C. | 在标准状况下,电子数为NA的HF分子所占体积为2.24L | |
| D. | 在Zn+2HNO3+NH4NO2═Zn(NO3)2+N2↑+3H2O反应生成5.6g N2(常温),转移电子数为NA |
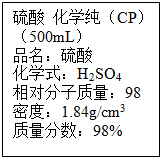 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.