题目内容
10.将200mL 0.3mol•L-1的NaOH溶液和100mL 0.6mol•L-1的NaOH溶液混合,如果不考虑混合时体积的变化,所得溶液中NaOH的物质的量浓度(单位:mol•L-1)为( )| A. | 0.3 | B. | 0.4 | C. | 0.45 | D. | 0.6 |
分析 先根据n=cV计算出两溶液中NaOH的物质的量,从而得出混合液中氢氧化钠的总物质的量,再根据c=$\frac{n}{V}$计算出混合液中氢氧化钠的物质的量浓度.
解答 解:200mL 0.3mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.3×0.2L=0.06mol,
100mL 0.6mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.6mol/L×0.1L=0.06mol,
则混合液中氢氧化钠的总物质的量为:0.06mol+0.06mol=0.12mol,混合液体积为:0.2L+0.1L=0.3L,
则混合液中氢氧化钠的物质的量浓度为:$\frac{0.12mol}{0.3L}$=0.4mo/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度概念及表达式即可解答,注意混合液中溶质的物质的量不变,试题培养了学生灵活运用基础知识的能力.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
5.用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:

(1)仪器D的名称是锥形瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式CH3CH2CH2CH2OH+NaBr+H2SO4 $\stackrel{加热}{→}$ CH3CH2CH2CH2Br+NaHSO4+H2O.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从d(填c或d)处流入,迅速升高温度至101.6℃,收集所得馏分.
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.

(1)仪器D的名称是锥形瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式CH3CH2CH2CH2OH+NaBr+H2SO4 $\stackrel{加热}{→}$ CH3CH2CH2CH2Br+NaHSO4+H2O.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.
6.为了证明某溶液中是否含有Fe3+,下列操作正确的是( )
| A. | 加入铜片 | B. | 通入氯气 | C. | 滴加KSCN溶液 | D. | 加入铁粉 |

 和
和 等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最少,写出其可能的结构简式及名称.
等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最少,写出其可能的结构简式及名称. ,名称2,2,4-三甲基戊烷.
,名称2,2,4-三甲基戊烷. ,名称2,3,3-三甲基戊烷.
,名称2,3,3-三甲基戊烷.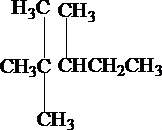 ,名称2,2,3-三甲基戊烷.
,名称2,2,3-三甲基戊烷.