��Ŀ����
����Ŀ����һ���¶��£�������X������Y ��0.16 mol����10 L �����ܱ������У�������ӦX(g)+ Y(g)![]() 2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ���� ( )
2Z(g) ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ���� ( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ��Ӧǰ2min��ƽ������v(Z)=2.0��10-5mol/(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)��v(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D. �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������
���𰸡�C
�����������������A��ǰ2min��v(Y)=![]() mol/(Lmin)=2.0��10-3 mol/(Lmin)��ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ���v(Z)=2v(X)=4.0��10-3 mol/(Lmin)����A����B���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ�ﵽ��ƽ��ǰv(��)��v(��)����B����C����Ӧ��7minʱ���÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��ƽ��ʱc(X)=c(Y)=0.10/10mol/L=0.01mol/L��c(Z)=
mol/(Lmin)=2.0��10-3 mol/(Lmin)��ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ���v(Z)=2v(X)=4.0��10-3 mol/(Lmin)����A����B���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ�ﵽ��ƽ��ǰv(��)��v(��)����B����C����Ӧ��7minʱ���÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��ƽ��ʱc(X)=c(Y)=0.10/10mol/L=0.01mol/L��c(Z)=![]() mol/L��2=0.012mol/L����ѧƽ�ⳣ��K=
mol/L��2=0.012mol/L����ѧƽ�ⳣ��K=![]() =1.44����C��ȷ��D��ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ�����ƽ��ʱX������������䣬��D����ѡC��
=1.44����C��ȷ��D��ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ�����ƽ��ʱX������������䣬��D����ѡC��

����Ŀ��X��Y��WΪԭ���������ε����Ķ�����Ԫ�أ�X��Yͬ���壬Y��W����̬�⻯�������ͬ�ĵ�������һ�������X�ĵ���ֻ�������ԣ�
��1��д��ʵ������ȡW2��Ӧ�����ӷ���ʽ�� ��
��2��ijС�������ͼ��ʾ��ʵ��װ�ã�ͼ�мгֺͼ���װ����ȥ��,�ֱ��о�YX2��W2�����ʡ�
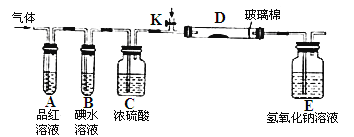
���ֱ�ͨ��YX2��W2����װ��A�й۲쵽�������Ƿ���ͬ ��������ͬ����������ͬ��������װ��D��װ�������ۣ���ͨ��W2ʱD�й۲쵽������Ϊ ����װ��D��װ������������������ͨ��YX2ʱ����Kͨ������X2����ѧ����ʽΪ ��
����װ��B��װ��5.0mL1.0��10-3mol/L�ĵ�ˮ����ͨ������W2��ȫ��Ӧ��ת����5.0��10-5mol���ӣ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��ijͬѧ��������YX2ͨ��һ֧װ���Ȼ�����Һ���Թܣ�δ���������ɣ�����Թ��м������ ������ĸ�����Կ�����ɫ�������ɡ�
A����ˮ | B��ϡ���� | C��ϡ���� | D���Ȼ��� |
��4������Ԫ��Y��X���-2�����Z��Z��Y��X��������ΪY:X=4:3����W2�뺬Z����Һ��ȫ��Ӧ����dz��ɫ����������ȡ�ϲ���Һ���������Ȼ�����Һ���а�ɫ���������������ֳ�����������ȡ�д��W2��Z����Һ��ȫ��Ӧ����dz��ɫ���������ӷ���ʽ: ��
