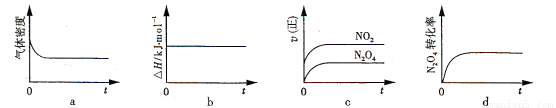题目内容
今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb=11∶9
C
【解析】
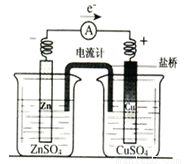
试题分析:A、已知醋酸铵溶液呈中性,这说明醋酸和氨水的电离程度是相同的。在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,NH4+结合OH-生成难电离的一水合氨,OH-浓度降低,两溶液的pH均减小,A正确;B、氢氧化钠和氯化氢是强电解质,完全电离。醋酸和氨水是弱酸与弱碱,存在电离平衡,稀释促进电离,则四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③,B正确;C、氨水是弱碱,pH=11的氨水溶液浓度大于0.001mol/L,则①、④两溶液等体积混合,氨水过量,溶液显碱性,则所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),C不正确;D、VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4,这说明盐酸过量,则 =0.0001,解得Va ∶Vb=11∶9,D正确,答案选C。
=0.0001,解得Va ∶Vb=11∶9,D正确,答案选C。
考点:考查弱电解质的电离、盐类水解、溶液稀释以及pH的计算

某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
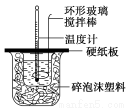
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热 (填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会 (填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会 (填“偏大”、“偏小”或“不变”),其原因是 。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH= 。根据计算结果,写出该中和反应的热化学方程式 。