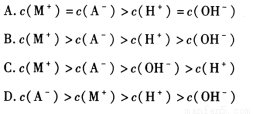题目内容
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
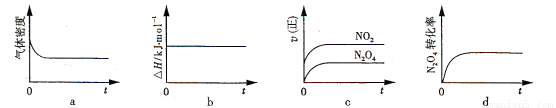
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
(每空2分,共14分)(1)N2O4 (2) a、d 不变 0.1
(3)NH4++H2O NH3·H2O+H+ 逆向
NH3·H2O+H+ 逆向 
【解析】
试题分析:(1)根据反应(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g)可知,(CH3)2NNH2中氮元素的化合价从-2价升高到0价,N2O4中氮元素的化合价从+4价降低到0价,因此氧化剂是N2O4。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。a、密度是混合气的质量和容器容积的比值,在反应过程中质量不变,但容器容积是变化的,因此当密度不再发生变化时可以说明反应达到平衡状态,a正确;b、对于具体的化学反应,反应热是恒定的,不能说明反应达到平衡状态,b不正确;c、反应物的正反应速率是逐渐减小的,而生成物的正反应速率是逐渐增大,所以c不正确;d、当反应物的转化率不再发生变化时,说明正逆反应速率相等,达到平衡状态,d正确,答案选ad;平衡常数只与温度有关系,所以此时平衡常数不变;反应3s后NO2的物质的量为0.6mol,则根据方程式可知,消耗N2O4的物质的量是0.3mol,其浓度是0.3mol÷1L=0.3mol/L,则0~3s内的平均反应速率v(N2O4)=0.3mol/L÷3s=0.1mol·L-1·s-1。
(3)NH3NO3溶于水电离出的NH4+水解,溶液显酸性,水解方程式为NH4++H2O NH3·H2O+H+;氨水是弱碱,电离出的OH-抑制水的电离,所以滴加氨水的过程中的水的电离平衡将逆向移动;溶液显中性,则根据电荷守恒可知c(NO3-)+c(OH-) =c(NH4+)+c(H+),因此 c(OH-)=c(H+)=10-7mol/L, c(NH4+)=c(NO3-)。根据氨水的电离平衡常数可知,溶液中
NH3·H2O+H+;氨水是弱碱,电离出的OH-抑制水的电离,所以滴加氨水的过程中的水的电离平衡将逆向移动;溶液显中性,则根据电荷守恒可知c(NO3-)+c(OH-) =c(NH4+)+c(H+),因此 c(OH-)=c(H+)=10-7mol/L, c(NH4+)=c(NO3-)。根据氨水的电离平衡常数可知,溶液中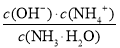 =2×10-5 mol·L-1,则c(NH3·H2O)=
=2×10-5 mol·L-1,则c(NH3·H2O)= =
=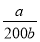 。
。
考点:考查氧化还原反应、平衡状态判断、反应速率计算以及盐类水解、电离平衡常数的计算

 名校通行证有效作业系列答案
名校通行证有效作业系列答案今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb=11∶9