题目内容
【题目】工业上以氯气和石灰乳为原料制造漂白粉.漂白粉的有效成分是( )
A.Cl2
B.CaCl2
C.Ca(OH)2
D.Ca(ClO)2
【答案】D
【解析】解:以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,Ca(ClO)2具有强氧化性,为漂白粉的有效成分,故选D.

【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
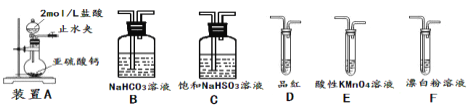
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A![]() ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
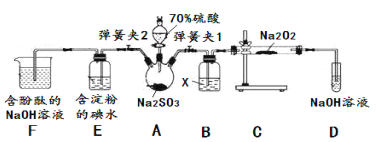
操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
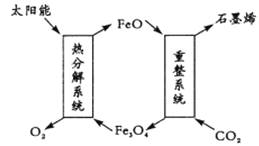
【题目】二氯化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和 __________;
②重整系统发生反应的化学方程式为______________________________。
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
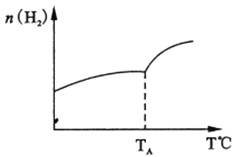
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将_____________(填“增大”、“ 减小”或“不变”);
②△H________0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 ________ H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq) ![]() NH4+ (aq) +OH-(aq) △H1=a kJmol-1
NH4+ (aq) +OH-(aq) △H1=a kJmol-1
CO2 (g) + H2O(l)![]() H2CO3 (aq) △H2=bkJmol-1
H2CO3 (aq) △H2=bkJmol-1
H2CO3(aq) + OH-(aq)![]() HCO3-(aq) + H2O(l) △H3=ckJmol-1
HCO3-(aq) + H2O(l) △H3=ckJmol-1
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为_____________________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5mol L-1 |
Ka1(H2CO3) | 4×10-7mol L-1 |
Ka2(H2CO3) | 4×10-11mol L-1 |
则反应NH4++HCO3-+H2O![]() NH3 H2O+ H2CO3的平衡常数k=___________。
NH3 H2O+ H2CO3的平衡常数k=___________。
