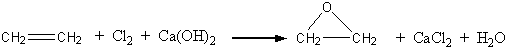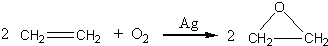题目内容
室温下,下列溶液中微粒的物质的量浓度关系不正确的是( )
分析:A.滴加稀NaOH溶液至中性,反应后为硫酸钠、硫酸钠、一水合氨的混合物;
B.碳酸氢根离子水解显碱性;
C.由电荷守恒可知,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为
c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-);
D.HB-可能为强酸的酸式酸根离子,可能为弱酸的酸式酸根离子.
B.碳酸氢根离子水解显碱性;
C.由电荷守恒可知,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为
| 1 |
| 2 |
D.HB-可能为强酸的酸式酸根离子,可能为弱酸的酸式酸根离子.
解答:解:A.滴加稀NaOH溶液至中性,反应后为硫酸钠、硫酸钠、一水合氨的混合物,NaOH的量大,则c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故A正确;
B.碳酸氢根离子水解显碱性,则NaHCO3溶液中c(Na+)>c(HCO3-)>c(OH-)>c(H+),故B正确;
C.由电荷守恒可知,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为
c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),则c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故C错误;
D.HB-可能为强酸的酸式酸根离子,不水解,若可能为弱酸的酸式酸根离子,水解时其离子浓度变小,则NaHB溶液中c(Na+)=0.01 mol/L≥c(B2-),故D正确;
故选C.
B.碳酸氢根离子水解显碱性,则NaHCO3溶液中c(Na+)>c(HCO3-)>c(OH-)>c(H+),故B正确;
C.由电荷守恒可知,c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为
| 1 |
| 2 |
D.HB-可能为强酸的酸式酸根离子,不水解,若可能为弱酸的酸式酸根离子,水解时其离子浓度变小,则NaHB溶液中c(Na+)=0.01 mol/L≥c(B2-),故D正确;
故选C.
点评:本题考查离子浓度大小的比较,明确混合时物质的量及反应后溶液中的溶质即可解答,注意电荷守恒、物料守恒的应用,题目难度中等,选项C为解答的难点.

练习册系列答案
相关题目
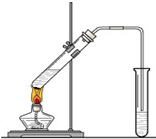 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: