题目内容
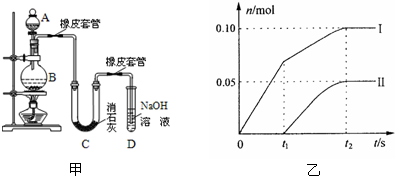
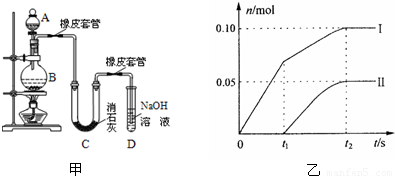
I? “套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要更多仪器进行的实验。因其具有许多优点,被广泛应用于化学实验中,如图实验为“套管实验”,小试管内塞有沾有无水硫酸铜粉末的棉花球。请观察实验装置,分析实验原理,回答下列问题:
 ???
???
(1)该实验的目的是_____________________
(2)实验开始前微热试管,说明装置不漏气的现象是???????????????????????????????
(3)一段时间后结束实验,待装置冷却,取出小试管中固体溶于水,然后滴加1mol/L盐酸,产生CO2的量与盐酸的量的关系如图所示。其中合理的是________________

II燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极反应式???
(2)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
写出电解总反应的离子方程式????????????????????? ???????????????

(3)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)
????????????? ①计算消耗标准状况下甲烷???????? mL
????????????? ②若图中的B点pH=7,则酸碱恰好完全反应的点在??????? 区间(填“AB”、“BC”或“CD”)
????????????? ③AB区间溶液中各离子浓度大小关系中可能正确的是?????????????????
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)???
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
(I)(1)探究(或证明)碳酸氢钠不稳定,受热易分成解产生CO2和H2O,而碳酸钠稳定。
(2)A、B导管末端均有气泡产生,冷却后均有液柱回流(3)B、C????
(II)(1)O2+2H2O+4e-=4OH— (2)2Cl—+2H2O 2OH—+H2↑+Cl2↑
2OH—+H2↑+Cl2↑
(3)? ① 280???? ② A B?????? ③ A B C
【解析】
试题分析:(I)(1)两个试管内分别装有Na2CO3、NaHCO3,给它们加热,病用澄清的石灰水来检验CO2的产生。就是来探究二者的热稳定性的相对大小。(2)实验开始前微热试管,说明装置不漏气的现象是A、B导管末端均有气泡产生,冷却后均形成稳定的水柱。(3)NaHCO3不稳定,受热分解2NaHCO3 Na2CO3+2H2O+CO2↑。向固体中加入HCl时首先发生反应:Na2CO3+HCl=NaCl+NaHCO3;无气体产生,当该反应完全后,再发生反应 NaHCO3+HCl=NaCl+H2O+ CO2↑。放出气体。因此,若NaHCO3完全分解,则两步消耗的HCl的物质的量相等,体积也相等。若它部分分解,则发生第一步消耗的HCl就比第二步少些。B为部分分解的图像;C为完全分解的图像。选项为BC。(II) (1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。其正极反应式为O2+2H2O+4e-=4OH—。(2)电解KCl溶液,阳离子放电能力H+>K+,所以H+在阴极放电产生氢气,阴离子放电能力Cl->OH-。所以H+在阴极放电产生氯气。总反应的离子方程式2Cl—+2H2O
Na2CO3+2H2O+CO2↑。向固体中加入HCl时首先发生反应:Na2CO3+HCl=NaCl+NaHCO3;无气体产生,当该反应完全后,再发生反应 NaHCO3+HCl=NaCl+H2O+ CO2↑。放出气体。因此,若NaHCO3完全分解,则两步消耗的HCl的物质的量相等,体积也相等。若它部分分解,则发生第一步消耗的HCl就比第二步少些。B为部分分解的图像;C为完全分解的图像。选项为BC。(II) (1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。其正极反应式为O2+2H2O+4e-=4OH—。(2)电解KCl溶液,阳离子放电能力H+>K+,所以H+在阴极放电产生氢气,阴离子放电能力Cl->OH-。所以H+在阴极放电产生氯气。总反应的离子方程式2Cl—+2H2O  2OH—+H2↑+Cl2↑。(3)①开始时pH=13, c(OH-)=0.1mol/L, v(OH-)=1L,所以n(OH-)=0.1mol.根据方程式可知转移电子0.1mol.则消耗CH4的物质的量为0.1mol÷8=0.0125mol,所以V(CH4)=0.0125mol× 22.4 L/mol=0.28L=280ml. ②酸碱恰好完全反应得到CH3COOK是强碱弱酸盐,水解显碱性,所以若图中的B点pH=7,则酸碱恰好完全反应的点在AB间。③AB区间溶液可能是酸碱完全反应得到CH3COOK,也可能是KOH过量时的KOH与CH3COOK的混合溶液。若KOH过量,且KOH>CH3COOK,则离子浓度大小关系为c(K+)>c(OH-)>c (CH3COO-) >c(H+)A正确。若KOH<CH3COOK,存在关系:c(K+)>c(CH3COO-)>c(OH-) >c(H+);若恰好反应,由于CH3COO—水解消耗,促进了水的电离,最终使溶液中的离子c(OH-)>c(H+)。存在关系:c(K+)>c(CH3COO-)>c(OH-) >c(H+)。B正确。若产生的CH3COOK与剩余的KOH物质的量相等,则c(K+)>c(CH3COO-)=c(OH-) >c(H+)。C正确。因此选项为ABC。
2OH—+H2↑+Cl2↑。(3)①开始时pH=13, c(OH-)=0.1mol/L, v(OH-)=1L,所以n(OH-)=0.1mol.根据方程式可知转移电子0.1mol.则消耗CH4的物质的量为0.1mol÷8=0.0125mol,所以V(CH4)=0.0125mol× 22.4 L/mol=0.28L=280ml. ②酸碱恰好完全反应得到CH3COOK是强碱弱酸盐,水解显碱性,所以若图中的B点pH=7,则酸碱恰好完全反应的点在AB间。③AB区间溶液可能是酸碱完全反应得到CH3COOK,也可能是KOH过量时的KOH与CH3COOK的混合溶液。若KOH过量,且KOH>CH3COOK,则离子浓度大小关系为c(K+)>c(OH-)>c (CH3COO-) >c(H+)A正确。若KOH<CH3COOK,存在关系:c(K+)>c(CH3COO-)>c(OH-) >c(H+);若恰好反应,由于CH3COO—水解消耗,促进了水的电离,最终使溶液中的离子c(OH-)>c(H+)。存在关系:c(K+)>c(CH3COO-)>c(OH-) >c(H+)。B正确。若产生的CH3COOK与剩余的KOH物质的量相等,则c(K+)>c(CH3COO-)=c(OH-) >c(H+)。C正确。因此选项为ABC。
考点:考查Na2CO3、NaHCO3的热稳定性及它们与酸反应的情况;电解原理、溶液中离子浓度的比较。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案