题目内容
5.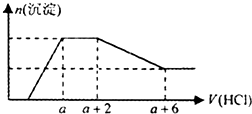 某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )
某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应最后形成的溶液中的溶质只有NaCl | |
| C. | 原溶液中含有CO32-与AlO2- 的物质的量之比为1:2 | |
| D. | 原溶液中一定含有的阴离子是:OH-、CO32-、SiO32-、AlO2- |
分析 根据图象曲线变化可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含氢氧根离子,则与氢氧根离子不能共存的有Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2-与HCO3-发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3-;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有钠离子离子,据此进行解答.
解答 解:由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的是Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-、SiO32-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2-与HCO3-发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3-;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;
A.溶液中硫酸根离子不能确定,剩余原溶液不中一定含有Na2SO4,故A错误;
B.依据图象可知和碳酸根离子反应的盐酸为2体积,CO32-+2H+=CO2↑+H2O 氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3+3H+=Al3++3H2O,原溶液中含有CO32-与AlO2-的物质的量之比为3:4,故B错误;
C.反应最后形成的溶液中的溶质为NaCl和AlCl3,故C错误;
D.依据判断原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,故D正确;
故选D.
点评 本题考查了离子检验的方法应用,题目难度中等,正确分析图象曲线变化为解题关键,注意掌握硅酸根离子、偏铝酸根离子、氢氧化铝的化学性质及检验方法,试题培养了学生的分析、理解能力及灵活应用能力.

| A. | Na、K合金熔点低、沸点高,可用作原子反应堆导热液 | |
| B. | SiO2具有高沸点,可用作制备光导纤维 | |
| C. | NH3具有还原性,可用作制冷剂 | |
| D. | HF是强酸,可用于雕刻玻璃 |
| A. | 1.5 mol | B. | 1.0 mol | C. | 3.0 mol | D. | 2.4 mol |
 阅读、分析下列两个材料:
阅读、分析下列两个材料:材料一:如图
材料二:如表
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是D;
(2)去除纯碱中的少量氯化钠杂质,最好应用C;
(3)将乙二醇和丙三醇相互分离的最佳方法是A.
| A. | KNO3是钾盐、硝酸盐,也是正盐 | |
| B. | 铝土矿、水玻璃、碱石灰都是混合物 | |
| C. | 有机玻璃、氮化硅都是有机高分子材料 | |
| D. | BaSO4、Na3AlF6、NH4F都是强电解质 |
| A. | 用酒精灯的内焰给试管加热 | |
| B. | 向燃着的酒精灯内添加酒精 | |
| C. | 用量筒代替试管作反应容器 | |
| D. | 称量药品时,砝码放在托盘天平的右盘 |
| A. | 是碳元素的三种同位素 | |
| B. | 是不同的原子 | |
| C. | 化学性质完全不同 | |
| D. | 其中的 14C和14N所含的质量数相等 |
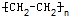 反应类型加聚反应(或聚合反应);
反应类型加聚反应(或聚合反应); 反应类型取代反应
反应类型取代反应 _反应类型加聚反应
_反应类型加聚反应