题目内容
16.在2L容器中发生3A+B?2C的反应,最初加入的A、B都是4mol,若10s 后反应达到平衡,测得A的平均反应速率为0.15mol•L-1•s-1,则10s后容器内B的物质的量为( )| A. | 1.5 mol | B. | 1.0 mol | C. | 3.0 mol | D. | 2.4 mol |
分析 同一化学反应同一时间段内各物质的反应速率之比等于其计量数之比,根据A的反应速率计算B的反应速率,总物质的量减去参加反应的B的物质的量就是剩余B的物质的量,据此分析解答.
解答 解:同一化学反应同一时间段内各物质的反应速率之比等于其计量数之比,则v(A)=$\frac{1}{3}$×0.15mol•L-1•s-1=0.05mol/(L.s),10s参加反应的B的物质的量=0.05mol/L.s×10s×2L=1mol,则剩余B的物质的量=4mol-1mol=3mol,故选C.
点评 本题考查化学反应速率有关计算,为高频考点,明确反应速率之比与其计算量之比关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.下列说法中正确的是( )
| A. | 1mol•L-1的NaCl溶液是指此溶液中含有1mol NaCl | |
| B. | 从1L0.5mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 25℃时,1mol Cl2的体积约为22.4L | |
| D. | 1mol•L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol/L |
4.下列说法错误的是( )
| A. | 从1L1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1mol•L-1 | |
| B. | 配制0.5L 10 mol•L-1的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为1.806×1024 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4 mol•L-1硫酸的浓度是不同的 |
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2L N2含有的分子数为NA | |
| B. | 标准状况下,18g H2O所占的体积约是22.4L | |
| C. | 32gO2在标准状况下所占的体积约为22.4L | |
| D. | 1mol Ne中约含有6.02×1024个电子 |
8.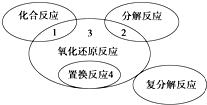 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
5.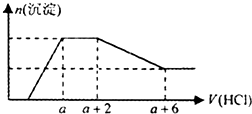 某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )
某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )
 某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )
某溶液中可能含有SiO32-、OH-、CO32-、SO42-、AlO2-、HCO3-、Na+、Mg2+、Fe3+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示.下列说法正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应最后形成的溶液中的溶质只有NaCl | |
| C. | 原溶液中含有CO32-与AlO2- 的物质的量之比为1:2 | |
| D. | 原溶液中一定含有的阴离子是:OH-、CO32-、SiO32-、AlO2- |
6.某无色溶液进行如表操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加稀盐酸 | 有气泡产生 | 原溶液中有CO32- |
| B | 滴加盐酸酸化的 BaCl2溶液 | 生成白色沉淀 | 原溶液中有Ag+ 或SO42- |
| C | 用洁净铂丝蘸取溶液 进行灼烧 | 火焰呈黄色 | 原溶液中有Na+、 无K+ |
| D | 滴加稀NaOH溶液,将湿 润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
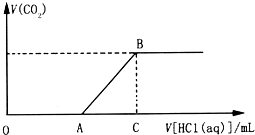 向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):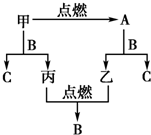 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.