题目内容
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为___。
(2)CH3COOH中碳原子的杂化形式为___。
(3)NO3-的空间构型是___,与NO3-互为等电子体的分子的化学式为___(任写一种)。
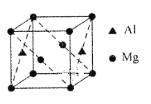
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为___,该晶体的密度为___g/cm3(阿伏伽德罗常数的数值用NA表示)。
【答案】3d54s2 sp3和sp2 平面三角形 BF3或BCl3 4 ![]()
【解析】
(1)锰为25号元素,基态锰原子的价层电子为其3d、4s能级上的电子;
(2)CH3COOH中甲基上C原子价层电子对个数是4、羧基上C原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化形式;
(3)根据价层电子对个数=σ键个数+孤电子对个数,判断NO3-离子的空间构型,与NO3-互为等电子体的分子中含有4个原子、价电子数是24;
(4)根据晶胞结构判断晶体中每个镁原子周围距离最近的铝原子数目;根据晶体的密度=![]() 计算。
计算。
(1)锰为25号元素,价层电子为其3d、4s能级上的电子,基态锰原子的价层电子排布式为3d54s2 ,故答案为:3d54s2;
(2) CH3COOH中甲基上的碳原子含有4个σ键,没有孤电子对,采用sp3杂化,羧基上的碳原子含有3个σ键,没有孤电子对,采用sp2杂化,故答案为:sp3和sp2;
(3)NO3一中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2,空间构型为平面三角形,NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
=3,N原子轨道的杂化类型为sp2,空间构型为平面三角形,NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
(4)在晶胞中,镁原子位于顶点和2个面的面心,铝原子位于2个面的面心,每个镁原子周围距离最近的铝原子数目为4个,距离均为面对角线长度的一半;晶胞棱长为anm,则晶胞体积=(a×10-7)3cm3,晶胞的质量=![]() g=
g=![]() g,则晶胞的密度=
g,则晶胞的密度=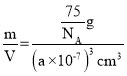
![]()
=![]() g/cm3,故答案为:4;
g/cm3,故答案为:4;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案