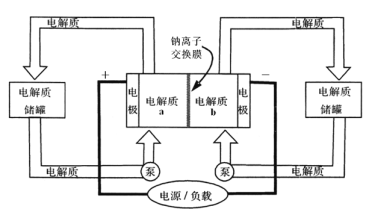
题目内容
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是__________,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:____________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为_______。
【答案】Na2O2、KOH H2O ![]()
![]() Na3N+4HCl==3NaCl+NH4Cl
Na3N+4HCl==3NaCl+NH4Cl
【解析】
(1)既含有离了键,又含有共价键的物质,通常含有金属元素,且含有原子团;共价化合物通常为不含金属元素的化合物;
(2)CaCl2由钙离子和氯离子构成;
(3) Na3N由Na+和N3-构成;
(4)Na3N与盐酸反应生成两种盐,则产物为NaCl和NH4Cl。
(1) Na2O2、CaCl2、KOH、NaF为含有金属元素的化合物,都为离子化合物,Na2O2、KOH中分别含有O22-、OH-原子团,都含有共价键,而CaCl2、NaF不含有共价键。从而得出既含有离了键,又含有共价键的物质是Na2O2、KOH;不含有离子键的化合物,是共价化合物,从而得出属于共价化合物的是H2O。答案为:Na2O2、KOH;H2O;
(2) CaCl2由钙离子和氯离子构成,则用电子式表示CaCl2的形成过程为:![]() 。答案为:
。答案为:![]() ;
;
(3) Na3N由Na+和N3-构成,电子式是![]() 。答案为:
。答案为:![]() ;
;
(4)Na3N与盐酸反应生成NaCl和NH4Cl,反应的化学方程式为Na3N+4HCl==3NaCl+NH4Cl。答案为:Na3N+4HCl==3NaCl+NH4Cl。

练习册系列答案
相关题目