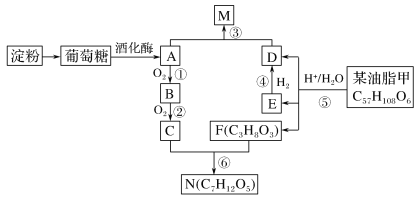
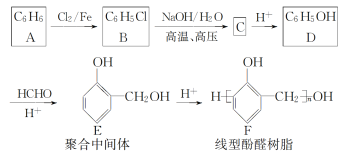
题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
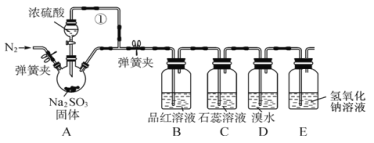
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
【答案】钾 铝 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2=S↓+2Cl- 稀硫酸 Na2SiO3溶液 有白色沉淀产生
【解析】
I.(1)同一周期元素,金属性随着原子序数增大而减弱,同一主族,原子序数越大,金属性越强,元素的金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则钾与盐酸反应最剧烈,铝与盐酸反应最慢,故答案为:钾;铝;
Ⅱ.(2)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;
(3)要验证氯的非金属性大于硫的;可以通过氯气和硫化钠反应置换出单质硫来证明,由于制取氯气时没有加热,选择高锰酸钾与浓盐酸反应制氯气,故装置A、B、C中所装药品分别为浓盐酸、 KMnO4、 Na2S ;装置C中的实验现象为有黄色沉淀生成,离子方程式为S2-+Cl2=S↓+2Cl-,故答案为:浓盐酸;KMnO4;Na2S ;S2-+Cl2=S↓+2Cl-;
(4)若要证明非金属性:S>C>Si,可通过实验证明S、C、Si的最高价含氧酸酸性依次减弱判断;通过硫酸制备二氧化碳,二氧化碳和硅酸钠溶液反应生成难溶性的硅酸来证明,故A中可以加稀硫酸,通过稀硫酸和碳酸钠的反应来制取CO2,然后将生成的CO2通入C中的Na2SiO3溶液中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,离子反应为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,产生白色胶状沉淀,从而可以证明酸性:H2SO4>H2CO3>H2SiO3,故答案为:稀硫酸; Na2SiO3溶液;有白色沉淀产生。

【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。