题目内容
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
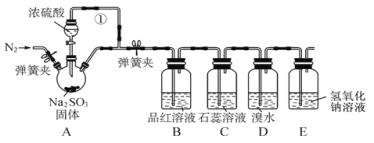
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
【答案】分液漏斗 H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O 平衡气压,便于浓硫酸顺利滴下 溶液褪色 还原 吸收SO2气体,防止污染空气 2OH-+SO2=SO32-+H2O(或OH-+SO2=HSO3-)
【解析】
在装置A中用浓硫酸与亚硫酸钠反应制取SO2,用B中的品红溶液检验SO2的漂白性,在C中检验其水溶液的酸性,在D中检验其还原性,由于SO2是大气污染物,因此用E的NaOH溶液进行尾气处理。
(1) 装置A中用于添加浓硫酸的仪器名称为分液漏斗;装置A中的浓硫酸和亚硫酸钠发生复分解反应,生成SO2、硫酸钠和水,反应的化学方程式为 H2SO4+Na2SO3=Na2SO4+SO2↑+H2O;
(2)反应产生气体,使烧瓶内的气压变大,若没有导管①平衡压强,分液漏斗内液体不能够顺利流下,所以导管①的作用是平衡气压,便于浓硫酸顺利滴下;
(3)在D中二氧化硫与溴水发生氧化还原反应生成硫酸和HBr,反应为SO2+Br2+2H2O=2HBr+H2SO4,溶液变为无色,其中SO2中S元素的化合价升高,说明SO2具有还原性;
(4)SO2有毒,会污染空气,根据其是酸性氧化物,能够与碱反应,产生可溶性盐的性质,常用NaOH溶液吸收处理,反应化学方程式为2NaOH+SO2=Na2SO3+H2O,即离子方程式为2OH-+SO2=SO32-+H2O,若SO2过量,则离子方程式为OH-+SO2=HSO3-。