题目内容
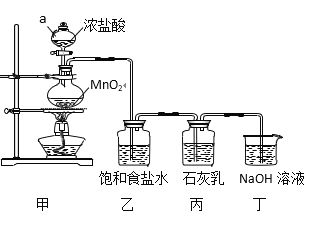
【题目】下面是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)

(1)装置 B 中饱和食盐水的作用是____。
(2)装置 D 的作用是验证氯气是否具有漂白性,为此 D 中Ⅰ、Ⅱ、Ш 处依次放入物质的组合应是____(填字母编号)。
编号 | Ⅰ | Ⅱ | Ш |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(3)设计装置 F 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E 中少量溶液加入装置F中,振荡,观察到的现象是 ____,该现象____(填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是____。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目 ____。
②在该反应中,氧化剂是____。
③上述反应中,有126. 4 g 的 KMnO4 参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙多少克?_____________
【答案】除去Cl2中混有的HCl气体 d F中溶液分为两层,上层(苯层)为紫红色,下层无色 不能 过量的Cl2也能将I-氧化为I2 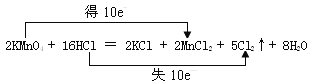 KMnO4 求得n(KMnO4) = 0. 8 mol 由关系式4 n(KMnO4)~10 n(Cl2)~5 n[Ca(ClO)2]得:n[Ca(ClO)2]=
KMnO4 求得n(KMnO4) = 0. 8 mol 由关系式4 n(KMnO4)~10 n(Cl2)~5 n[Ca(ClO)2]得:n[Ca(ClO)2]=![]() n(KMnO4)=
n(KMnO4)= ![]() ×0. 8 mol =1. 0 mol m[Ca(ClO)2]= n[Ca(ClO)2] ×M[Ca(ClO)2]= 1. 0 mol×143g/mol=143g 即理论上可得到143克次氯酸钙
×0. 8 mol =1. 0 mol m[Ca(ClO)2]= n[Ca(ClO)2] ×M[Ca(ClO)2]= 1. 0 mol×143g/mol=143g 即理论上可得到143克次氯酸钙
【解析】
(1)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用装置 B 中饱和食盐水吸收氯气中的氯化氢气体;
(2)装置D的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中AB的II中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性; D中II为固体干燥剂,不能为浓硫酸,所以D中I、II 、Ⅲ依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d;
(3)据图可知,E中通入氯气后生成单质溴,加入F中后又生成了单质碘,故F中现象是溶液分层,且上层即苯层显紫红色,但是由于E中可能有过量的氯气,故F中生成的单质碘不一定是溴与KI反应置换出来的,也可能是过量的Cl2将I-氧化为I2,故不能说明溴单质的氧化性一定比碘强;
故答案为:F中溶液分为两层,上层(苯层)为紫红色,下层无色;不能;过量的Cl2也能将I-氧化为I2;
(4)①反应中Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,该反应中转移10e-,双线桥法标出电子转移的方向和数目为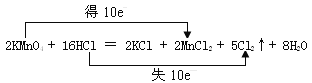 ;
;
②KMnO4中Mn元素的化合价由+7价降低为+2价,氧化剂为KMnO4;
③根据题目条件可知,发生的反应有:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2Cl2+2Ca(OH)2= Ca(ClO)2+CaCl2+2H2 O;
求得n(KMnO4) = 0. 8 mol;由关系式4 n(KMnO4)~10 n(Cl2)~5 n[Ca(ClO)2]得:n[Ca(ClO)2]=![]() n(KMnO4)=
n(KMnO4)= ![]() ×0. 8 mol =1. 0 mol,
×0. 8 mol =1. 0 mol,
m[Ca(ClO)2]= n[Ca(ClO)2] ×M[Ca(ClO)2]= 1. 0 mol×143g/mol=143g 即理论上可得到143克次氯酸钙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案