题目内容
1.今需配制pH=7.4的磷酸缓冲溶液1000mL,问需用0.1mol/L Na2HPO4和0.1mol/L NaH2PO4溶液各多少毫升(H3PO4的Ka2=6.2×10-8)分析 根据缓冲公式计算需要的两种盐的物质的量,根据质量计算物质的量,进而根据V=$\frac{n}{c}$计算溶液的体积即可.
解答 解:H3PO4的Ka2=6.2×10-8,pKa=7.2,根据缓冲公式:pH=pKa+lg$\frac{c(Na{H}_{2}P{O}_{4})}{c(N{a}_{2}HP{O}_{4)}}$,7.8=7.2+lg$\frac{c(Na{H}_{2}P{O}_{4})}{c(N{a}_{2}HP{O}_{4)}}$,在配置1L溶液中,lg$\frac{n(Na{H}_{2}{PO}_{4})}{n(N{a}_{2}HP{O}_{4})}$,设Na2HPO4和 NaH2PO4溶液的物质的量分别为n1,n2,则有n1+n2=0.1,联立解得n1=0.0387,n2=0.0613,
所以Na2HPO4得体积=$\frac{0.0613mol}{0.1mol/L}$=0.613L=613mL;NaH2PO4的体积=$\frac{0.0387mol}{0.1mol/L}$=0.387L=387mL,
答:Na2HPO4:613mL;NaH2PO4:387mL.
点评 本题考查了缓冲溶液的配置等相关知识,注意教材知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
9.一定质量的铁铝合金完全溶于过量的热浓硝酸中,反应中共产生13.44L的NO2(标况下),若在反应后的溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量不可能为( )
| A. | 7.8g | B. | 10.7g | C. | 15.6g | D. | 21.4g |
16.下列说法中正确的是( )
| A. | SO3溶于水能导电,故SO3属于电解质 | |
| B. | H2SO4是强电解质,H2SO4在水溶液里和熔融状态下,都能导电 | |
| C. | BaSO4难溶于水.故BaSO4属于弱电解质 | |
| D. | 氢离子浓度相同的盐酸和醋酸导电能力相同 |
6.下列物质性质与应用对应关系正确的是( )
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 氧化铝熔点很高,可用于制耐火材料 | |
| C. | 新制氢氧化铜悬浊液具有碱性,可用于检验醛基 | |
| D. | 浓硫酸具有脱水性,可用于干燥氯气 |
13.在探究某地刚落下的酸雨成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 在酸雨试样中加入Ba(NO3)2溶液有白色沉淀,说明酸雨中一定含SO42- | |
| B. | 将酸雨试样浓缩后加入Cu和浓H2SO4,试管口有红棕色气体,逸出说明酸雨中可能含NO3- | |
| C. | 每隔1 h测定酸雨试样的pH,其pH先变小后不变,说明刚落下的酸雨中含SO32- | |
| D. | 用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在Na+ |
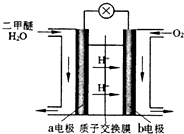 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下: