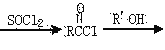题目内容
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
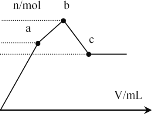
A.a点的溶液呈中性
B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
C.c点溶液呈碱性
D.c点加入Ba(OH)2溶液的体积为200 mL
【答案】C
【解析】
100mL 0.1molL -1 硫酸铝铵[NH4Al(SO4)2 ],NH4Al(SO4)2 物质的量为0.01mol。溶液含有NH4+ 0.01mol,Al 3+ 0.01mol,SO42- 0.02mol。关键弄清楚反应顺序,开始滴加同时发生反应为SO42- +Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;再滴加Ba(OH)2 ,生成BaSO4 沉淀,发生反应为SO42- +Ba2+=BaSO4 ↓,NH4++OH - =NH3H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42- 完全沉淀时,共需加入0.02molBa(OH)2 ,加入0.04molOH-,Al3+ 反应掉0.03molOH-,生成Al(OH)3 0.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3 ;继续滴加Ba(OH)2,Al(OH)3 溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3 完全溶解,需再加入0.005molBa(OH)2 ,此时溶液为氨水与偏铝酸钡溶液。
A.由分析可知,从开始到a点,发生反应为SO4 2- +Ba2+ =BaSO4 ↓,Al3++3OH- =Al(OH)3 ↓,a点对应的沉淀为BaSO4和Al(OH)3 ,溶液含有硫酸铵、硫酸铝,显酸性,故A错误;
B.由分析可知,b点发生反应为SO42-+Ba2+ =BaSO4↓,NH4++OH-=NH3H 2O,故B错误;
C.由分析可知,c为溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,故C正确;
D.由分析可知,c点加入Ba(OH)2 的物质的量为0.005mol+0.02mol=0.025mol,所以![]() =0.25L=250mL,故D错误;
=0.25L=250mL,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________;阴极产生NaOH_________mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________。