题目内容
【题目】以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
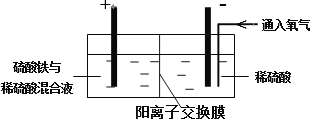
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
【答案】(16分)
(1)①吸收硫化氢气体,防止环境污染(1分)
②Fe2+- e-→Fe3+(1分)
(2)2H++2 e-→H2↑ Cu2++2e-→Cu 2Cu+O2+2H2SO4=2CuSO4+2H2O(各1分)
(3)分液漏斗 (1分)
富集Cu2+,分离Cu2+与其它金属阳离子(2分,每个要点1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
(5) c(H+)>c(SO42-)>c(Cu2+)>c(OH-)(2分)
【解析】试题分析:(1)①根据阳极区的Fe3+的浓度基本保持不变,说明有消耗,阳极区的主要反应,H2S有毒,对环境有污染,因此硫酸铁的作用是吸收硫化氢气体,防止环境污染;②就有生成,因此在阳极区Fe2+-2e-=Fe3+;(2)根据电解原理,以及信息,有气泡产生,2H++2e-=H2↑,有固体产生Cu2++2e-=Cu,固体消失2Cu+O2+2H2SO4=2CuSO4+2H2O;(3)有机相和水相互不相溶,分离时采用分液方法,使用分液漏斗;金属矿中金属含量低,一般先采用富集,因此有机萃取的目的是负极Cu2+,分离Cu2+与其它金属阳离子;(4)2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相),加入硫酸,增加H+浓度,促使平衡向正反应方向移动,Cu2+进入水相得以再生;(5)200mL0.5mol·L-1的CuSO4溶液中n(Cu2+)=200×10-3×0.5mol=0.1mol,电解一段时间后产生铜单质3.2g,溶液中含有0.05molCuSO4, 2CuSO4+2H2O
R2Cu(有机相)+ 2H+(水相),加入硫酸,增加H+浓度,促使平衡向正反应方向移动,Cu2+进入水相得以再生;(5)200mL0.5mol·L-1的CuSO4溶液中n(Cu2+)=200×10-3×0.5mol=0.1mol,电解一段时间后产生铜单质3.2g,溶液中含有0.05molCuSO4, 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,生成硫酸的物质的量为0.05mol,因水也发生电离产生H+和OH-,Cu2+发生水解,因此离子浓度大小顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2Cu+O2↑+2H2SO4,生成硫酸的物质的量为0.05mol,因水也发生电离产生H+和OH-,Cu2+发生水解,因此离子浓度大小顺序是:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。

【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
【题目】下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 | 主要成分 | 杂质 | 除杂试剂 | 分离操作 |
A | 铜粉 | 铁粉 | FeCl3溶液 | 过滤 |
B | Na2SO4 | Na2SO3 | 双氧水 | 结晶 |
C | SO2 | HCl | 饱和Na2CO3 | 洗气 |
D | MgO | Al2O3 | 盐酸 | 过滤 |
A. A B. B C. C D. D