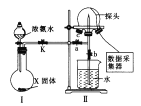
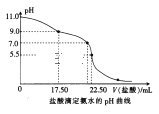
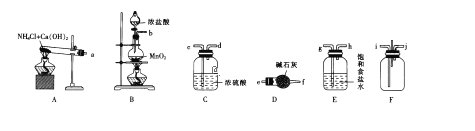
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
【答案】A
【解析】
A、1molNa2O2 固体中含离子总数为3NA;
B、醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进其电离;
C、12C和14C组成的氯气中两者的个数之比不明确;
D、二氧化硫和氧气的反应为可逆反应。
A项、78gNa2O2固体相当于1molNa2O2,故1molNa2O2 固体中含离子总数为3NA,故A正确;
B项、常温下向1LpH=1的醋酸溶液中氢离子的个数为0.1NA个,而醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进其电离,故加水稀释,所得溶液中H+数目大于0.1NA,故B错误;
C项、12C和14C组成的氯气中两者的个数之比不明确,故氯气的摩尔质量不能确定,则13g碳的物质的量无法计算,其含有的质子数不一定是6NA个,故C错误;
D项、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移的电子的个数小于0.2NA个,故D错误。
故选A。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有少量苯酚稀溶液的试管中逐滴加入饱和溴水,产生白色沉淀 | 苯酚与Br2反应生成2,4,6三溴苯酚 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | H2O2具有氧化性 |
C | 向FeCl3溶液中滴入少量KI溶液,再加入KSCN溶液,溶液变红 | Fe3+与I-的反应具有可逆性 |
D | 向蔗糖中滴加少量浓硫酸,搅拌,蔗糖变黑,体积膨松,变成疏松多孔的海绵状 | 浓硫酸具有脱水性和氧化性 |
A. AB. BC. CD. D