题目内容
【题目】图甲、乙所示装置分别进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
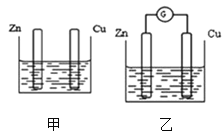
(1)以下叙述中,正确的是__。
A.甲乙装置中锌片均是负极
B.两烧杯中铜片均产生气泡
C.两烧杯中溶液的pH均增大
D.甲电池工作时,电子经电解质溶液回到Zn极形成闭合的回路
(2)若反应过程中有2mol电子发生转移,则生成的氢气在标况下的体积为__。
【答案】C 22.4L
【解析】
(1)A.甲装置因为没有形成闭合的回路,不是原电池,没有正极、负极,故A错误;
B.甲装置中锌片上产生气泡,铜片上没有气泡,乙装置则是铜片上产生气泡,故B错误;
C.由于两烧杯中实质都是锌与硫酸反应,消耗了硫酸,溶液酸性减弱,故pH值增大,故C正确;
D.甲装置不是原电池,且电子只能沿导线进行移动,不能经过电解质溶液,故D错误;
故本题答案为C;
(2)根据反应可知,发生2mol电子发生转移时,则生成1mol氢气,1mol H2在标准状况下的体积为22.4L。

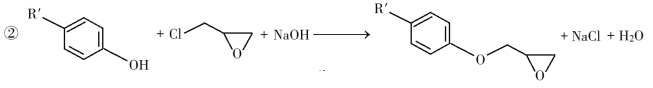
【题目】有机化工中3,5-二甲氧基苯酚是重要的有机合成中间体,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)1mol间苯三酚完全燃烧需要_____molO2。
(2)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是________。
②萃取用到的分液漏斗分液时有机层在分液漏斗的____填(“上”或“下”)层。
(3)分离得到的有机层依次用饱和NaHCO3溶液、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是__________________________ ;
(4)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_________(填字母)。
a.蒸馏除去乙醚 b.冷却结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(5)写出反应中可能出现的副产物结构简式______________(只要写一种即可)。
【题目】下列实验过程可以达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 制备Fe(OH)胶体 | 将NaOH浓溶液滴加到饱和FeCl溶液中 |
B | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L的NaOH溶液250mL | 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立刻转移至250 mL容量瓶中定容 |
A.AB.BC.CD.D