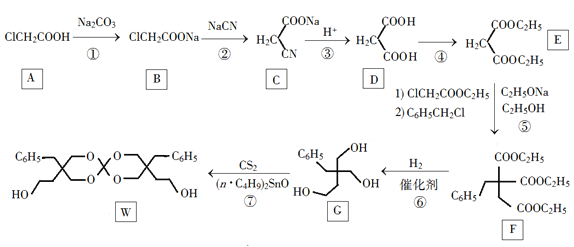
题目内容
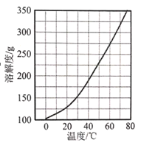
【题目】在固定容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A的物质的量为2mol,B的物质的量为3mol;5min末测得C的物质的量为1.5mol,用D表示的化学反应速率
3C(g)+nD(g),开始时A的物质的量为2mol,B的物质的量为3mol;5min末测得C的物质的量为1.5mol,用D表示的化学反应速率![]() (D))为0.1mol·L-1·min-1。计算:
(D))为0.1mol·L-1·min-1。计算:
(1)前5min内用A表示的化学反应速率v(A)为__。
(2)化学方程式中n的值为__。
(3)此反应在四种不同情况下的反应速率分别为
①![]() (A)=1mol·L-1·s-1②
(A)=1mol·L-1·s-1②![]() (B)=4mol·L-1·min-1③
(B)=4mol·L-1·min-1③![]() (C)=3mol·L-1·min-1④
(C)=3mol·L-1·min-1④![]() (D)=7mol·L-1·min-1
(D)=7mol·L-1·min-1
其中反应速率最快的是__(填序号)。
【答案】0.05mol/(L·min) 2 ①
【解析】
(1)先算出C的反应速率,![]() ,再根据反应速率之比等于化学计量数系数之比,
,再根据反应速率之比等于化学计量数系数之比,![]() ,故答案为:0.05mol/(L·min)
,故答案为:0.05mol/(L·min)
(2)根据反应速率之比等于化学计量系数比:
![]() ,故D的系数n=2,故答案为:2
,故D的系数n=2,故答案为:2
(3)比较同一化学反应不同物质表示的反应快慢,必须换算成同一物质相同的单位表示的化学反应速率进行比较,我们可以根据反应速率之比等于化学计量系数比进行换算,我们将它们统一换算为A表示则①![]() (A)=1mol·L-1·s-1=60 mol·L-1·min-1,
(A)=1mol·L-1·s-1=60 mol·L-1·min-1,
②当![]() (B)=4mol·L-1·min-1时,
(B)=4mol·L-1·min-1时,![]() (A)=2 mol·L-1·min-1,
(A)=2 mol·L-1·min-1,
③![]() (C)=3mol·L-1·min-1时,
(C)=3mol·L-1·min-1时,![]() (A)=1mol·L-1·min-1,
(A)=1mol·L-1·min-1,
④当![]() (D) =7mol·L-1·min-1时,
(D) =7mol·L-1·min-1时,![]() (A)=3.5mol·L-1·min-1,故A表示的反应速率最快;故答案为:①
(A)=3.5mol·L-1·min-1,故A表示的反应速率最快;故答案为:①

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
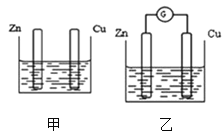
学练快车道口算心算速算天天练系列答案【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
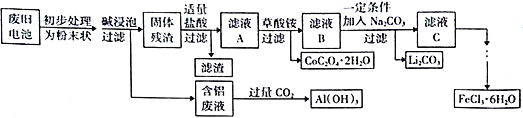
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③④C.①②④D.②③④