题目内容
【题目】![]() 在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
(1)氯化铁溶液腐蚀铜板的离子方程式: ______ .
(2)将5至6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体.
写出反应的离子方程式: ______ .
(3)向100mL![]() 硫酸铝铵
硫酸铝铵![]() 溶液中逐滴滴入
溶液中逐滴滴入![]()
![]() 溶液.随着
溶液.随着![]() 溶液体积V的变化,沉淀物质的量n的变化如图所示:
溶液体积V的变化,沉淀物质的量n的变化如图所示:
①请认真思考,写出相应的离子方程式:
OA段: ______
OB段: ______
BC段: ______
CD段: ______

②当![]() 离子恰好全部沉淀时,生成
离子恰好全部沉淀时,生成![]() 物质的量为 ______ mol.
物质的量为 ______ mol.
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体;
(3)①100mL 0.1molL-1硫酸铝铵[NH4Al(SO4)2],根据它的物质的量.计算出溶液含有NH4+,Al3+,SO42-的物质的量,根据消耗的氢氧化钡的物质的量和沉淀的物质的量关系可以确定OA段是生成硫酸钡的反应,OB段是铝离子完全沉淀的反应,BC段沉淀的量没变,BC是消耗铵根的反应,CD段是沉淀减少的过程,CD溶解氢氧化铝的反应,根据分析写出离子方程式;
②OA段是生成硫酸钡的反应,加入200ml氢氧化钡时,达到氢氧化铝的沉淀最大量,氢氧化铝没有溶解,图像上可以读出氢氧化铝的物质的量。
(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+;
(2)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为:![]() ;
;
(3)①100mL0.1molL-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol,关键弄清楚反应顺序,开始滴加氢氧化钡溶液,同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-0.02mol ,SO42-+Ba2+=BaSO4↓,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到B),再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液;
②根据以上分析不难得出,OA段是生成硫酸钡的反应,OB段是铝离子完全沉淀的反应,BC是消耗铵根的反应,CD溶解氢氧化铝的反应,根据以上分析不难得出,当SO42-离子恰好全部沉淀时,加入0.02molBa(OH)2,这时根据图象氢氧化铝没有开始溶解,故生成Al(OH)3物质的量仍为0.01mol。

【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
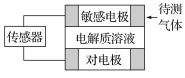
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同



