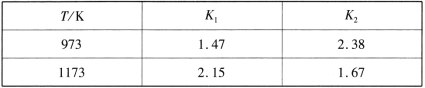
题目内容
【题目】A、B、C三种短周期元素,原子序数依次增大,三种元素原子序数之和为36,A、C同族,B2+离子核外有10个电子,回答下列问题:
(1)A、B、C三种元素的符号分别是_________、_________、_________
(2)A、B、C之间任取两种能形成多种化合物,其中属于共价化合物的化学式分别为_________、___________
(3)分别写出A、B的电子排布式:A_________、B________
(4)写出C的价电子轨道排布图:________
【答案】O Mg S SO2 SO3 1s22s22p4 1s22s22p63s2 ![]()
【解析】
B2+离子核外有10个电子,则B原子核外有12个电子,所以B为Mg,三种元素原子序数之和为36,且A、C同族,则A的原子序数为8,C的原子序数为16,所以A为O,C为S。
(1)根据分析,三种元素的符号分别是O、Mg、S;
(2)只含共价键的化合物为共价化合物,所以共价化合物为SO2、SO3;
(3)O为8号元素,原子核外有8个电子,所以电子排布式为1s22s22p4;Mg为12元素,核外有12个电子,电子排布式为1s22s22p63s2;
(4)S元素的价电子排布为3s23p4,排布图为![]() 。
。

【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如图:
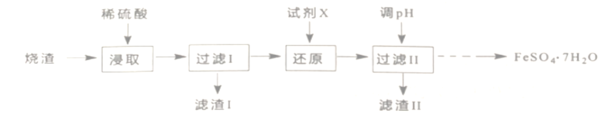
(1)滤渣I的主要成分是___(填化学式)。
(2)浸取过程中,可提高酸浸速率的措施有___ (任写一条)。
(3)还原时,若试剂X为一种单质,则X的化学式为___。
(4)若试剂X选用SO2,写出还原步骤的离子方程式:___。
(5)常见离子形成氢氧化物沉淀的pH见表,则该流程中pH应该调节为___(范围)。
pH | Al3+ | Fe2+ |
开始沉淀 | 3.0 | 5.8 |
完全沉淀 | 5.0 | 8.8 |
(6)从分离出滤渣II后的滤液中得到产品,应进行的操作是___、过滤、洗涤、干燥。