题目内容
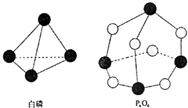 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ?mol-1)P-P:198 P-O:360 O═O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ?mol-1)P-P:198 P-O:360 O═O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )| A、释放1638kJ的能量 |
| B、吸收1638kJ的能量 |
| C、释放126kJ的能量 |
| D、吸收126kJ的能量 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,据此计算出反应P4(白磷)+3O2→P4O6的反应热,然后判断是吸热还是放热能量,注意每摩尔P4中含有6molP-P键.
解答:
解:各化学键键能为:P-P 198kJ?mol-1、P-O 360kJ?mol-1、O=O 498 kJ?mol-1,
反应热的焓变△H=反应物总键能-生成物总键能,
则反应P4(白磷)+3O2→P4O6的反应热为:△H=6×198kJ?mol-1+3×498kJ?mol-1-12×360kJ?mol-1=-1638kJ?mol-1,
说明该反应为放热反应,释放1638kJ能量,
故选A.
反应热的焓变△H=反应物总键能-生成物总键能,
则反应P4(白磷)+3O2→P4O6的反应热为:△H=6×198kJ?mol-1+3×498kJ?mol-1-12×360kJ?mol-1=-1638kJ?mol-1,
说明该反应为放热反应,释放1638kJ能量,
故选A.
点评:本题考查反应热与化学键键能的关系,题目难度中等,注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能及焓变的正负与吸收、放热热量的关系.

练习册系列答案
相关题目
科学家预言超级原子的发现将会重建周期表.美国科学家曾在《Science》上发表论文,宣布发现了Al的超级原子Al13和Al14.①Al13、Al14的性质很像现行周期表中的某主族元素,已知这类超级原子具有40个价电子时最稳定.②在质谱仪上检测到稳定的Al13-.下列说法不正确的是( )
| A、Al13与卤素原子性质相似,能形成稳定的Al13- |
| B、Al14与ⅡA族元素性质相似,容易失去2个电子形成稳定的Al142+ |
| C、Al14与HI反应的化学方程式为Al14+2HI═Al14I2+H2↑ |
| D、超级原子Al13中铝原子间是通过离子键结合的 |
碲的某化合物就是常用的VCD光盘记录材料之一,碲位于钾的下一周期,与氧元素同一主族,对碲及其化合物的以下认识中不正确的是( )
| A、单质碲在常温下是固体 |
| B、H2TeO4的酸性比H2SO4的酸性弱 |
| C、H2Te不如HI稳定 |
| D、Te元素位于第六周期ⅥA族 |
已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )
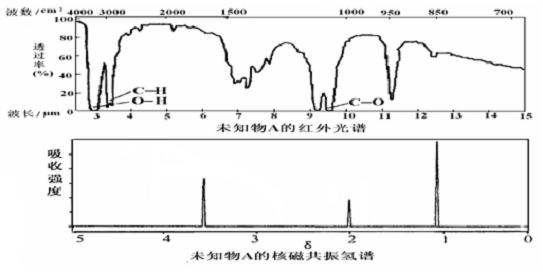

| A、由红光外谱可知,该有机物中至少有三种不同的化学键 |
| B、由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 |
| C、仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
| D、若A的化学式为C3H6O,则其结构简式为CH3CH2CHO |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A、25℃,等pH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3 |
| B、少量的SO2通入NaClO溶液中反应的离子方程式为:SO2+H2O+2ClO-→SO32-+2HClO |
| C、少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2+H2O+ClO-→HCO3-+HClO |
| D、向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 |
运用元素周期律分析下面的推断,其中错误的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹化银不溶于水也不溶于稀硝酸 |
| C、硫酸镭是难溶于水的白色固体 |
| D、锗单质是一种优良的半导体材料 |
化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述正确的是( )
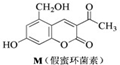

| A、M与Br2只能发生加成反应,不能发生取代反应 |
| B、M既能与FeCl3发生反应,也能与CH3COOH发生反应 |
| C、M可溶于NaOH稀溶液,1mol M最多消耗2mol NaOH |
| D、1mol M在催化剂作用下最多能与4mol H2发生加成反应 |
将一定量铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体的体积为4.48L(标准状况下),则原溶液中硝酸的浓度为( )
| A、1.0mol?L-1 |
| B、0.8mol?L-1 |
| C、0.6mol?L-1 |
| D、0.4mol?L-1 |