题目内容
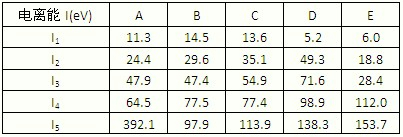
(1)下表为原子序数依次增大的短周期元素A~ E的第一到第五电离能数据.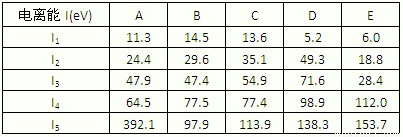
请回答:表中的金属元素是______(填字母),其中化合价为+3价的是______(填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______.
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,石墨烯的碳源可以由一氧化碳、乙醇、酞菁等中的一种或任意组合提供.
①钴原子在基态时,核外电子排布式为______.
②乙醇沸点比氯乙烷高,主要原因是______.
③与CO分子互为等电子体的分子和离子各写出1种,分别为______和______(填化学式)
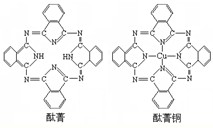
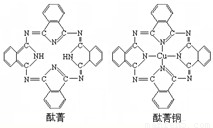
④酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是______;酞菁铜分子中心原子的配位数为______.
【答案】分析:(1)金属元素的第一电离能比较小,第一个电子易失去,通过表格可以看出第一电离能比较小属于金属元素;前三电离能比较小,第四电离能突然增大,此元素的化合价为+3价;同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,第一电离能比较大,为特殊情况;
(2)①元素周期表中元素的位置及核外电子排布,27号元素钴的核外电子排布式为[Ar]3d74s2;
②分子间形成氢键使沸点升高;
③等电子体为电子数相等;
④已知结构式判断中心原子的杂化类型和配位数,C-N=C中氮为sp3杂化,C-NH-C中氮为sp2 杂化.
解答:解:(1)金属元素的第一电离能比较小,第一个电子容易失去,通过表格可以看出DE的第一电离能比较小;化合价为+3价,说明前三电离能比较小,第四电离能突然增大,故符合的只有E;
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,有特殊情况为,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为(1)D E;E;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大;
(2)①钴原子为27号元素,核外电子排布式为[Ar]3d74s2
②乙醇沸点比氯乙烷高,是因为乙醇分子间可形成氢键,而氯乙烷分子间无氢键,形成氢键使沸点升高;
③等电子体为电子数相等,一氧化碳中电子数为14,与CO分子互为等电子体的分子和离子分别为N2 CN-等;
④C-N=C中氮为sp3杂化,C-NH-C中氮为sp2 杂化;酞菁铜中铜左右的两个氮是在酞菁的基础上失去两个氢反应而来,而上下两个氮则是提供孤电子对与铜直接键和,跟金属离子直接键合的原子有几个,配位数就为几,可知铜的配位数为2;
故答案为(2)①[Ar]3d74s2
②乙醇分子间可形成氢键,而氯乙烷分子间无氢键;
③N2 CN-;
④sp3和sp2;2.
点评:本题考查了金属元素的电离能特点,第一个电离能较小,元素的化合价为+n价,前n电离能比较小,第n+1电离能突然增大,同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,造成第一电离能比较大;元素周期表中元素的位置及核外电子排布,分子间形成氢键使沸点升高,等电子体,判断中心原子的杂化类型和配位数等知识点.
(2)①元素周期表中元素的位置及核外电子排布,27号元素钴的核外电子排布式为[Ar]3d74s2;
②分子间形成氢键使沸点升高;
③等电子体为电子数相等;
④已知结构式判断中心原子的杂化类型和配位数,C-N=C中氮为sp3杂化,C-NH-C中氮为sp2 杂化.
解答:解:(1)金属元素的第一电离能比较小,第一个电子容易失去,通过表格可以看出DE的第一电离能比较小;化合价为+3价,说明前三电离能比较小,第四电离能突然增大,故符合的只有E;
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,有特殊情况为,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为(1)D E;E;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大;
(2)①钴原子为27号元素,核外电子排布式为[Ar]3d74s2
②乙醇沸点比氯乙烷高,是因为乙醇分子间可形成氢键,而氯乙烷分子间无氢键,形成氢键使沸点升高;
③等电子体为电子数相等,一氧化碳中电子数为14,与CO分子互为等电子体的分子和离子分别为N2 CN-等;
④C-N=C中氮为sp3杂化,C-NH-C中氮为sp2 杂化;酞菁铜中铜左右的两个氮是在酞菁的基础上失去两个氢反应而来,而上下两个氮则是提供孤电子对与铜直接键和,跟金属离子直接键合的原子有几个,配位数就为几,可知铜的配位数为2;
故答案为(2)①[Ar]3d74s2
②乙醇分子间可形成氢键,而氯乙烷分子间无氢键;
③N2 CN-;
④sp3和sp2;2.
点评:本题考查了金属元素的电离能特点,第一个电离能较小,元素的化合价为+n价,前n电离能比较小,第n+1电离能突然增大,同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,造成第一电离能比较大;元素周期表中元素的位置及核外电子排布,分子间形成氢键使沸点升高,等电子体,判断中心原子的杂化类型和配位数等知识点.

练习册系列答案
相关题目