题目内容
下列关系正确的是
| A.等物质的量的Na2O2与Na2O 中阴离子个数之比为2:1 |
| B.标准状况下,等体积的CO2与CO中氧原子数之比为2:1 |
| C.pH相同的H2SO4(aq)与CH3COOH(aq)中的c(H+)之比为2:1 |
| D.等浓度的(NH4)2SO4 (aq)与NH4Cl(aq)中c(NH4+)之比为2:1 |
B
解析试题分析:A、等物质的量的Na2O2与Na2O ,1摩尔Na2O2中有1摩尔过氧根离子,阴离子个数之比为1:1,错误;B、标准状况下,等体积的CO2与CO的物质的量相同,氧原子数之比为2:1,正确;C、pH相同,c(H+)相同,错误;D、铵盐要发生水解,水解程度不同,错误。
考点:考查物质的组成与结构、阿伏伽德罗定律、pH计算、盐的水解

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
下列叙述正确的是
| A.1.7gOH-离子中含有的电子数目为NA |
| B.常温、常压下,22.4L氧气中含氧原子数目为2NA |
| C.常温下,0.1molC2H4分子中含共价键数目为0.5 NA |
| D.含1molH2SO4的浓硫酸和足量的铜反应转移电子数为NA |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.O2比O3质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
以下表示碳原子结构的化学用语中,对电子运动状态描述最详尽的是
A.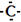 | B.1s22s22p2 | C.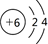 | D.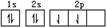 |
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
| A.0.4mol | B.0.55mol | C.0.6mol | D.0.65mol |
下列解释实验现象的反应方程式正确的是
| A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O |
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O 2CrO42—+2H+ 2CrO42—+2H+ |
| C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3 2Al+Fe2O3 |
下列化学用语与所述事实不相符的是
| A.用稀硫酸和氢氧化钠稀溶液的反应测中和热时的热化学方程式:H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ·mol-1 |
| B.铂作电极,以KOH溶液为电解质溶液的肼(N2H4)一空气燃料电池,放电时的负极反应式:N2H4-4e-+ 4OH- =N2↑+4H2O |
| C.用饱和碳酸钠溶液浸泡锅炉水垢的离子方程式:CO2- 3+CaSO4= CaCO3+SO2- 4 |
D.苯和液溴在一定条件下发生取代反应制取溴苯: |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.3mol NO2与足量的水完全反应,被氧化的NO2分子数为2NA |
| B.1 mol异丁烷中含有的共价键数为14NA |
| C.100 mL 18.4 mol/L的浓硫酸与足量的铜充分反应,生成SO2的分子数目为0.92 NA |
| D.甲烷碱性燃料电池中,负极消耗22.4 L甲烷同时消耗10 NA的OH- |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为2NA |
| B.常温常压下,22.4L氯气与足量镁粉充分反应,转移电子数为2NA |
| C.标准状况下,11.2LCCl4含有的分子数目为0.5NA |
| D.标准状况下,22.4L氦气所含原子数为2NA |