题目内容
【题目】某研究性学习小组将下列装置如图连接,E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____,丁中____(填“X”或“Y”)极颜色会加深。
(2)欲用丙装置给铜镀银,H应该是____,电镀液的主要成分是____(填化学式)。
(3)如果收集乙装置中产生的气体,相同条件下两种气体的体积比是___。
(4)甲装置为使用过的铅蓄电池,充电后电极D应与用电器的____(填“正”或“负”)极连接,电极C上的电极反应式为____。
【答案】正极 Y Cu AgNO3 1:1 负 PbSO4 - 2e-+ 2H2O = PbO2 + SO42-+ 4H+
【解析】
将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,则F为阴极,因此电源的A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,结合电解原理和胶体的电泳分析解答。
根据上述分析,A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极。
(1)A是电源的正极,B是电源的负极;根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的胶体粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:正极;Y;
(2)给铜镀银,应该选用金属银作阳极,纯铜作阴极,含有银离子的硝酸银溶液作电解质溶液,即H为纯铜,电镀液的主要成分是AgNO3,故答案为:Cu;AgNO3;
(3)电解饱和食盐水的原理是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,相同条件下,产生的氢气和氯气体积比为1∶1,故答案为:1∶1;
2NaOH+H2↑+Cl2↑,相同条件下,产生的氢气和氯气体积比为1∶1,故答案为:1∶1;
(4)甲装置为使用过的铅蓄电池,充电后电极D为负极,使用时应与用电器的负极连接,电极C为阳极,发生氧化反应,电极反应式为PbSO4 - 2e-+ 2H2O = PbO2 + SO42-+ 4H+,故答案为:负;PbSO4 - 2e-+ 2H2O = PbO2 + SO42-+ 4H+。

【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
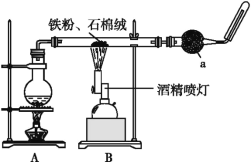
(1)已知该实验反应的反应方程式为:Fe+H2O![]() Fe3O4+H2(请配平)____。
Fe3O4+H2(请配平)____。
(2)仪器a的名称是________。
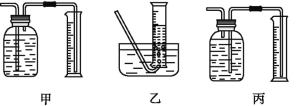
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃___(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,则铁粉的转化率为___。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反应后的溶液中阳离子为_______ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |