题目内容
【题目】2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________;
②Fe3+比Fe2+稳定的原因是_____________________;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________,与CN-互为等电子体的分子有__________(写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
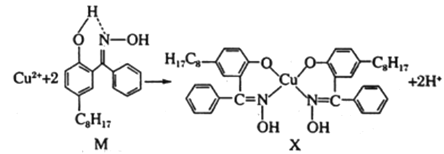
①M所含元素的电负性由大到小的顺序为__________(用元素符号表示);
②X中采用sp3杂化的非金属原子有___________(填写元素名称),采用sp3杂化的原子有__________个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________mol-1。(列出含a、b的计算式)
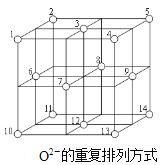 (白球表示O2-)
(白球表示O2-)
【答案】![]() Fe3+价层电子排布式为3d5,处于半充满的稳定状态 2NA CO def O>N>C>H C、O 9
Fe3+价层电子排布式为3d5,处于半充满的稳定状态 2NA CO def O>N>C>H C、O 9 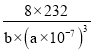
【解析】
(1)①Si元素原子序数为14,核外电子排布式为1s22s22p63s23p2,可知其L能层有2个s电子,6个p电子,电子分布图为![]() ;
;
②Fe是26号元素,Fe原子失去最外层的2个4s电子变为Fe2+,核外电子排布式为1s22s22p63s23p63d6,价层电子排布式为3d6,当Fe2+再失去1个3d电子时,价层电子排布式变为3d5,处于d轨道的半充满的稳定状态,所以Fe3+比Fe2+稳定;
③CN-中C、N原子间通过三键结合,其中含有1个σ键,2个π键,则1 mol CN-中含有π键的数为2NA;由于等电子体中原子总数相等,价电子总数也相等,所以与CN-互为等电子体的分子是CO;铁氰化钾K3[Fe(CN)6]为离子晶体,含有离子键,在络离子[Fe(CN)6]3-中,中心Fe3+与配位体之间通过配位键结合,在配位体CN-中含有共价键,化合物中不含有金属键、氢键、范德华力,故合理选项是def;
(2)①根据M结构简式可知其中含有C、H、O、N四种元素,由于同一周期元素的电负性随原子序数的增大而增大,则O>N>C,H元素的非金属性最弱,其电负性最小,故这四种元素的电负性由大到小的顺序为:O>N>C>H;
②根据X示意图可知烃基-C8H17中的8个C原子及羟基-OH原子采用sp3杂化,而N原子形成C、N双键,采用sp2杂化,所以X中采用sp3杂化的非金属原子有C、O,采用sp3杂化的原子数目由8+1=9;
(3)根据O2-排布图示可将Fe3O4变为如图所示结构:
其中Fe2+离子处于晶胞的顶点、面心以及A位置立方体的体心。O2-位于A、B小立方体的内部,每个小立方体内部各有4个O2-。Fe3+离子处于晶胞B位置小立方体内部,每个B中含有4个Fe3+,晶胞中Fe2+离子数目=4+8×![]() +6×
+6×![]() =8,Fe3+离子数目=4×4=16,O2-离子数目=4×8=32,故晶胞中Fe2+、Fe3+、O2-的个数比为8:16:32,晶胞相当于有8个“Fe3O4”,晶胞质量m=8×
=8,Fe3+离子数目=4×4=16,O2-离子数目=4×8=32,故晶胞中Fe2+、Fe3+、O2-的个数比为8:16:32,晶胞相当于有8个“Fe3O4”,晶胞质量m=8×![]() g,该晶体的晶胞参数为a nm,密度为b g/cm3,所以b=
g,该晶体的晶胞参数为a nm,密度为b g/cm3,所以b= =
= ,故NA=
,故NA=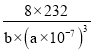 。
。

 阅读快车系列答案
阅读快车系列答案【题目】(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
时间/s | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01 mol/L,则此时反应处于____状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10 mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
② 清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
③ 滴定过程中发现一段时间后反应速率明显加快,除去温度的影响,你认为最有可能的原因是____。
【题目】现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
X | 原子的1s轨道上只有1个电子 |
Y | 原子的L层上s电子数等于p电子数 |
Z | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9% |
(1) Z2X4分子中Z原子采取________杂化,写出与之互为等电子体的有机物的结构简式_____________________
(2) Cl2T分子的空间构型___________, Z2T的电子式_________________
(3) 请用价层电子对互斥理论解释ZX![]() 和ZX3的键角∠XZX的大小:_____________。
和ZX3的键角∠XZX的大小:_____________。
(4) Y晶体的晶胞如图所示,该晶胞含有______个Y原子,若晶胞的密度为d g·cm-3,阿伏加德罗常数的值为NA(mol-1),则晶胞参数为a=_______ pm。(用含d 、NA的式子表示)