题目内容
【题目】FeCl2是一种常用的还原剂。有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水.易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
实验室可以用多种方法来制备无水FeCl2,回答下列问题:
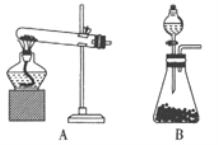
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是_________;E中盛放的试剂是_________;D中反应的化学方程式为_________。

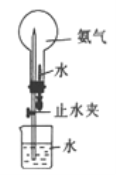
II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128—139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HC1
(1)该制取反应中,作还原剂的是_________。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是_________。
(3)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是_________;
②回收滤液中C6H5Cl的方法是_________。
(4)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中试剂可以是加有酚酞,且理论上含_________g NaOH的溶液。
【答案】 干燥氢气 碱石灰 H2+2FeCl3![]() 2FeCl2+2HC1 C6H5Cl 实验使用了冷凝回流装置 苯 蒸馏滤液,并收集132℃馏分 18
2FeCl2+2HC1 C6H5Cl 实验使用了冷凝回流装置 苯 蒸馏滤液,并收集132℃馏分 18
【解析】本题主要考查FeCl2的实验室制法。
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是干燥氢气;E中盛放的试剂是碱石灰,防止空气中的水蒸气进入D装置;D中反应的化学方程式为H2+2FeCl3![]() 2FeCl2+2HC1。
2FeCl2+2HC1。
II.(1)该制取反应中,FeCl3是氧化剂,作还原剂的是C6H5Cl。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是实验使用了冷凝回流装置。
(3)①C6H5Cl、C6H4Cl2易溶于苯,FeCl2不溶于苯,洗涤所用的试剂可以是苯;
②分离互溶液体的一般方法是蒸馏,回收滤液中C6H5Cl的方法是蒸馏滤液,并收集132℃馏分。
(4)162.5g无水氯化铁的物质的量是1mol,氯化铁转化率达到或超过90%,生成氯化氢的物质的量不少于0.45mol,烧杯中的酚酞在氢氧化钠耗尽时由红色变为无色,理论上与0.45molHCl发生反应消耗0.45mol即18gNaOH。

 名校课堂系列答案
名校课堂系列答案