题目内容
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH﹣ ④NH4+ ⑤Fe(CO)5⑥Fe(SCN)3⑦H3O+
⑧[Ag(NH3)2]OH ⑨[B(OH)4]﹣ .
A.①②④⑦⑧
B.③④⑤⑥⑦⑨
C.①④⑤⑥⑦⑧⑨
D.全部
【答案】C
【解析】解:①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键,故①正确;
②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键,故②错误;
③OH﹣电子式为 ![]() ,无空轨道,OH﹣不含有配位键,故③错误;
,无空轨道,OH﹣不含有配位键,故③错误;
④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键,故④正确;
⑤Fe(CO)5中Fe原子提供空轨道,CO提供孤对电子,可以形成配位键,故⑤正确;
⑥SCN﹣的电子式 ![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故⑥正确;
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故⑥正确;
⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键,故⑦正确;
⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,[Ag(NH3)2]OH含有配位键,故⑧正确;
⑨[B(OH)4]﹣离子中氧原子含有孤电子对,硼原子含有空轨道,B3+与OH﹣之间形成配位键,所以含有配位键,故⑨正确.
故选C.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化. 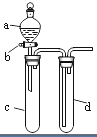
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是 .
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3 , 则分液漏斗a中加入的试剂是 , c中加入的试剂是 , d中加入的试剂是;实验现象为 . 但此实验存在不足之处,改进的措施是 .


