题目内容
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化. 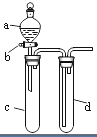
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是 .
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3 , 则分液漏斗a中加入的试剂是 , c中加入的试剂是 , d中加入的试剂是;实验现象为 . 但此实验存在不足之处,改进的措施是 .
【答案】
(1)检查装置的气密性
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(3)丙
(4)稀盐酸;大理石(或Na2CO3固体);Na2SiO3溶液;c中有气泡产生,d中生成白色胶状物质(或白色沉淀);在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶
【解析】解:(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是检查装置的气密性, 所以答案是:检查装置的气密性;(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
所以答案是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(3)方案甲是铜和浓硝酸反应生成硝酸铜,二氧化氮和水,有污染气体生成,不能体现绿色化学理念;方案乙是稀硝酸和铜反应生成硝酸铜,一氧化氮和水,有污染气体生成,不能体现绿色化学理念;丙是利用铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,反应过程中无污染气体生成,能体现绿色化学理念,
所以答案是:丙;(4)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,盐酸酸性最强,所以a中盛放硝酸,盐酸和碳酸钙制取二氧化碳,二氧化碳和硅酸钠溶液生成硅酸,则c中盛放碳酸钙、d中盛放硅酸钠,硅酸难溶于水,所以二氧化碳和硅酸钠反应生成硅酸沉淀,看到的现象是有白色沉淀生成,因盐酸易挥发,应在c和d之间加入除杂装置,用饱和碳酸氢钠溶液除去氯化氢,
所以答案是:稀盐酸;大理石(或Na2CO3固体);Na2SiO3溶液;c中有气泡产生,d中生成白色胶状物质(或白色沉淀);在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案