题目内容
已知:
①2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
计算反应C(s)+CO2(g)═2CO(g)的反应热△H为( )
①2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
计算反应C(s)+CO2(g)═2CO(g)的反应热△H为( )
| A.+172.51kJ/mol | B.-283.01kJ/mol |
| C.+283.01kJ/mol | D.+504.00kJ/mol |
①2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
利用盖斯定律,将①-②,可得C(s)+CO2(g)═2CO(g)△H=-221.0kJ?mol-1+393.51kJ/mol=+172.51kJ/mol,
故选:A.
②C(s)+O2(g)═CO2(g)△H=-393.51kJ/mol
利用盖斯定律,将①-②,可得C(s)+CO2(g)═2CO(g)△H=-221.0kJ?mol-1+393.51kJ/mol=+172.51kJ/mol,
故选:A.

练习册系列答案
相关题目
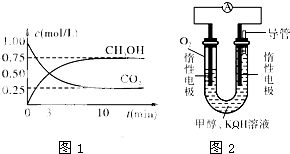
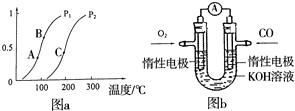
 位时间内生成n mol A,同时生成3n mol B
位时间内生成n mol A,同时生成3n mol B 数之比为1:3:2
数之比为1:3:2