题目内容
2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.
(1)科学家们提出利用工业废气中的CO2可制取甲醇.已知在常温常压下,反应的热化学方程式:①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ?mol-1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41kJ?mol-1,写出由二氧化碳、氢气制备甲醇的热化学方程式:______.
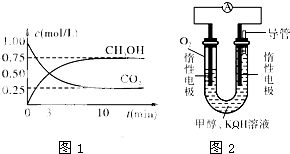
(2)在体积为1L的密闭容器中,充入1molCO2和2.5molH2在图1示条件下测得CO2和CH3OH(g)的物质的量随时间变化如图所示.
①从反应开始到平衡,平均反应速率v(H2)=______;
②反应的平衡常数K=______;
③下列对二氧化碳、氢气制备甲醇的有关叙述正确的是______(填字母).
A.升高温度正反应速率减慢,逆反应速率加快
B.当3v正(H2)=v逆(CO2)时,该反应达到了平衡状态
C.将H2O(g)从体系中分离出来,可提高CO2和H2的转化率
D.再充入1molCO2和3molH2,可使n(CH3OH)/n(CO2)增大
(3)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的燃料电池装置.
①该电池工作时,OH-向______极移动(填“正”或“负”),该电池正极的电极反应式为:______.
②以该燃料电池作为电源,电解精炼铜.若粗铜中含锌、银、金等杂质,则通电一段时间后,阳极减少的质量将(填“大于”、“等于”或“小于”)______阴极增加的质量.当阴极质量增加64g时,该燃料电池理论上需消耗O2的体积为______L(标准状况下).
(1)科学家们提出利用工业废气中的CO2可制取甲醇.已知在常温常压下,反应的热化学方程式:①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ?mol-1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41kJ?mol-1,写出由二氧化碳、氢气制备甲醇的热化学方程式:______.
(2)在体积为1L的密闭容器中,充入1molCO2和2.5molH2在图1示条件下测得CO2和CH3OH(g)的物质的量随时间变化如图所示.
①从反应开始到平衡,平均反应速率v(H2)=______;
②反应的平衡常数K=______;
③下列对二氧化碳、氢气制备甲醇的有关叙述正确的是______(填字母).
A.升高温度正反应速率减慢,逆反应速率加快
B.当3v正(H2)=v逆(CO2)时,该反应达到了平衡状态
C.将H2O(g)从体系中分离出来,可提高CO2和H2的转化率
D.再充入1molCO2和3molH2,可使n(CH3OH)/n(CO2)增大
(3)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的燃料电池装置.
①该电池工作时,OH-向______极移动(填“正”或“负”),该电池正极的电极反应式为:______.
②以该燃料电池作为电源,电解精炼铜.若粗铜中含锌、银、金等杂质,则通电一段时间后,阳极减少的质量将(填“大于”、“等于”或“小于”)______阴极增加的质量.当阴极质量增加64g时,该燃料电池理论上需消耗O2的体积为______L(标准状况下).

(1)根据盖斯定律和已知热化学方程式:①CO(g)+2H2(g)═CH3OH(g)△H1=-90kJ?mol-1;②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41kJ?mol-1,可知二氧化碳、氢气制备甲醇的热化学方程式可由①-②得出,即:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49kJ?mol-1;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49kJ?mol-1;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,v(CH3OH)=0.075mol/(L?min),
由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知:v(H2)=3v(CH3OH)=3×0.075mol/(L?min)=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度 1 2.5 0 0
转化浓度 0.75 2.25 0.75 0.75
平衡浓度 0.25 0.25 0.75 0.75
则该反应的平衡常数k=c(CH3OH)c(H2O)/c(CO2)c3(H2)=144;
故答案为:144;
③A.升高温度,正、逆反应速率都加快;故A错误;
B.当该反应达到平衡状态时,v正(H2)=3v逆(CO2);故B错误;
C.将H2O(g)从体系中分离出来,减小生成物的浓度,平衡右移,可提高CO2和H2的转化率;故C正确;
D.再充入1molCO2和3molH2,相当于充入1molCO2和2.5molH2达平衡后再通入0.5molH2.等效为在定温定压达平衡后增大压强再增大H2的浓度,平衡向正反应移动,CO2的转化率增大,CH3OH的产率提高;则n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
(3)①该燃料电池工作时,阴离子向负极移动,因为氧气在碱性电解质溶液中得电子,所以电池正极的电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:负;O2+2H2O+4e-=4OH-;
②阳极上金属锌、铜都失电子发生氧化反应,阴极上铜离子得电子发生还原反应而析出铜,根据转移电子守恒以及锌比铜相对原子质量大但价态相同,可知A电极上质量减少的量大于B极质量增加的量;当阴极质量增加64g铜时,根据电子守恒:n(Cu)×2=n(O2)×4,得n(O2)=0.5mol,V(O2)=11.2L
故答案为:大于; 11.2.
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49kJ?mol-1;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,v(CH3OH)=0.075mol/(L?min),
由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知:v(H2)=3v(CH3OH)=3×0.075mol/(L?min)=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度 1 2.5 0 0
转化浓度 0.75 2.25 0.75 0.75
平衡浓度 0.25 0.25 0.75 0.75
则该反应的平衡常数k=c(CH3OH)c(H2O)/c(CO2)c3(H2)=144;
故答案为:144;
③A.升高温度,正、逆反应速率都加快;故A错误;
B.当该反应达到平衡状态时,v正(H2)=3v逆(CO2);故B错误;
C.将H2O(g)从体系中分离出来,减小生成物的浓度,平衡右移,可提高CO2和H2的转化率;故C正确;
D.再充入1molCO2和3molH2,相当于充入1molCO2和2.5molH2达平衡后再通入0.5molH2.等效为在定温定压达平衡后增大压强再增大H2的浓度,平衡向正反应移动,CO2的转化率增大,CH3OH的产率提高;则n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
(3)①该燃料电池工作时,阴离子向负极移动,因为氧气在碱性电解质溶液中得电子,所以电池正极的电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:负;O2+2H2O+4e-=4OH-;
②阳极上金属锌、铜都失电子发生氧化反应,阴极上铜离子得电子发生还原反应而析出铜,根据转移电子守恒以及锌比铜相对原子质量大但价态相同,可知A电极上质量减少的量大于B极质量增加的量;当阴极质量增加64g铜时,根据电子守恒:n(Cu)×2=n(O2)×4,得n(O2)=0.5mol,V(O2)=11.2L
故答案为:大于; 11.2.

练习册系列答案
相关题目