题目内容
【题目】温度为T时,向2L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10min内反应的平均速率为v(D)=0.3mol·L-1·min-1
B.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
C.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
【答案】BD
【解析】
由图可知,平衡时A、D的物质的量变化量分别为1.5mol、3mol,故△n(A)∶△n(D)=1∶x=1.5∶3,所以x=2,该反应为气体体积增大的反应,△H>0,正反应为吸热反应,据此分析解答。
A.由图象可知,10min时反应到达平衡,平衡时D的物质的量变化量为3mol,故v(D)=![]() =
=![]() =0.15molL-1min-1,故A错误;
=0.15molL-1min-1,故A错误;
B.由图可知,反应至15 min时,改变条件瞬间,D的物质的量减小,A、B的物质的量增大,说明平衡向逆反应方向移动,根据上述分析,x=2,反应后气体的体积增大,缩小容器体积,压强增大,平衡逆向移动,因此改变的条件可能是缩小容器体积,故B正确;
C.平衡常数K只与温度有关,温度不变,K不变,故C错误;
D.由图可知,反应至15 min时,改变条件瞬间,D的物质的量减小,A、B的物质的量增大,说明平衡向逆反应方向移动,该反应的正反应为吸热反应,降低温度,平衡逆向移动,因此改变条件可能是降低温度,故D正确;
故选BD。

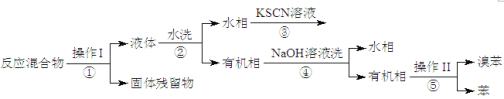
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
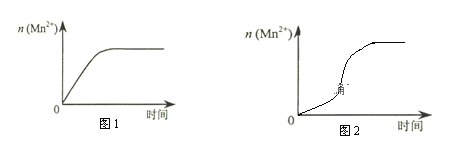
①该小组同学提出的假设是___________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是_____________________________________。