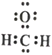题目内容
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
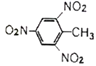
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
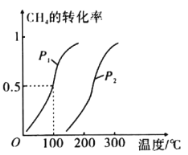
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

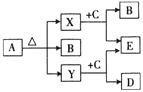
i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
【答案】![]() b、e
b、e ![]() (mol/L)1/2温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)增大反应物接触面积,使反应更充分H2S+2FeCl3===2FeCl2+S↓+2HCl2Fe2++2H+
(mol/L)1/2温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)增大反应物接触面积,使反应更充分H2S+2FeCl3===2FeCl2+S↓+2HCl2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】
(1)①无机材料K2O·M2O3·2RO2·nH2O中钾显+1价,氧显-2价,氢显+1价,则M显+3价,R显+4价;M、R为第3周期主族元素,质子数之和为27,则M、R原子的质子数分别为13、14,M、R分别是铝、硅,硅原子的结构示意图为 。
。
②由金属活动性顺序可得,铝比铜活泼,则铝与硫酸铜溶液可以发生置换反应,反应方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu,故a项不符合题意;
铝与氧化铁在高温下才能发生铝热反应,常温下不能反应,故b项符合题意;
浓硫酸具有强氧化性,常温下能使铝钝化,铝表面生成一层致密的保护膜,钝化是化学变化,故c项不符合题意;
氢氧化钠是强碱,铝单质与NaOH溶液容易反应,放出气体,故d项不符合题意;
常温下铝不能与碳酸钠固体反应,故e项符合题意,
综上所述,正确答案为b、e。
(2)①H2S起始浓度均为c mol·L-1,985 ℃时H2S的平衡转化率为40%,则H2S的变化浓度为0.4c mol·L-1,则:
H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
起始浓度/ mol·L-1 c 00
变化浓度/ mol·L-1 0.4c 0.4c0.2c
平衡浓度/ mol·L-1 0.6c 0.4c0.2c
K=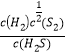 =
=![]() =
= ![]() (mol/L)1/2 ,
(mol/L)1/2 ,
温度逐渐升高,H2S分解的反应速率加快,达到平衡的时间缩短,在一定的时间内能更快的达到平衡,在图像上表现出来就是b渐渐向a逼近。
因此,本题正确答案为:![]() (mol/L)1/2;温度升高,反应速率加快,达到平衡所需的时间缩短;
(mol/L)1/2;温度升高,反应速率加快,达到平衡所需的时间缩短;
②由图可知,H2S气体从反应池底部通入,FeCl3溶液从反应池顶部喷下,这种采用气液逆流方式加入反应物的主要目的是增大反应物接触面积,使反应更充分;
由图可知,H2S中S被氧化,而FeCl3被还原为FeCl2,配平可得:H2S+2FeCl3===2FeCl2+S↓+2HCl;反应池中反应后溶液中主要成分是FeCl2、HCl,电解池中含有的Fe2+被氧化为Fe3+,H+被还原为H2,电解总反应的离子方程式:2Fe2++2H![]() 2Fe3++H2↑,
2Fe3++H2↑,
因此,本题正确答案为:增大反应物接触面积,使反应更充分;H2S+2FeCl3===2FeCl2+S↓+2HCl;2Fe2++2H+![]() 2Fe3++H2↑。
2Fe3++H2↑。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案