��Ŀ����
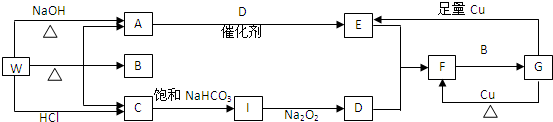
14��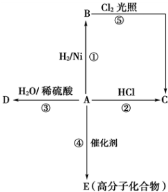 ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ�� һϵ�л�ѧ��Ӧ�����Т٢ڢ�����ͬ�ַ�Ӧ���ͣ�����ͼ�ش��������⣺
ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ�� һϵ�л�ѧ��Ӧ�����Т٢ڢ�����ͬ�ַ�Ӧ���ͣ�����ͼ�ش��������⣺д���ڡ��ܡ���������Ӧ�Ļ�ѧ����ʽ����ע����Ӧ���ͣ�
��CH2=CH2+HCl$\stackrel{����}{��}$CH3CH2Cl����Ӧ���ͼӳɷ�Ӧ��
��
 ����Ӧ���ͼӾ۷�Ӧ��
����Ӧ���ͼӾ۷�Ӧ����CH3CH3+Cl2$\stackrel{����}{��}$CH3CH2Cl+HCl����Ӧ����ȡ����Ӧ��
���� ��A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ������һ��ֲ���������ڼ�����AΪCH2=CH2����ϩ�����������ӳɷ�Ӧ����B��BΪ���飬��ϩ��HCl�����ӳɷ�Ӧ����C��CΪCH3CH2Cl����ϩ��ˮ�����ӳɷ�Ӧ����D��DΪ�Ҵ�����ϩ�����Ӿ۷�Ӧ���ɸ߷��ӻ�����E��E�Ǿ���ϩ���Դ������
��� �⣺��A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ������һ��ֲ���������ڼ�����AΪCH2=CH2����ϩ�����������ӳɷ�Ӧ����B��BΪCH3CH3����ϩ��HCl�����ӳɷ�Ӧ����C��CΪCH3CH2Cl����ϩ��ˮ�����ӳɷ�Ӧ����D��DΪCH3CH2OH����ϩ�����Ӿ۷�Ӧ���ɸ߷��ӻ�����E��E�Ǿ���ϩ���٢ڢ۾�Ϊ�ӳɷ�Ӧ��
��Ӧ������ϩ��HCl�����ӳɷ�Ӧ����CH3CH2Cl����Ӧ����ʽΪCH2=CH2+HCl$\stackrel{����}{��}$CH3CH2Cl��
��Ӧ��Ϊ���ɾ���ϩ�ļӾ۷�Ӧ����ӦΪ ��
��
��Ӧ���������������ڹ��������·���ȡ����Ӧ����CH3CH2Cl����Ӧ����ʽΪCH3CH3+Cl2$\stackrel{����}{��}$CH3CH2Cl+HCl��Ϊȡ����Ӧ��
�ʴ�Ϊ��CH2=CH2+HCl$\stackrel{����}{��}$CH3CH2Cl���ӳɷ�Ӧ�� ���Ӿ۷�Ӧ��CH3CH3+Cl2$\stackrel{����}{��}$CH3CH2Cl+HCl��ȡ����Ӧ��
���Ӿ۷�Ӧ��CH3CH3+Cl2$\stackrel{����}{��}$CH3CH2Cl+HCl��ȡ����Ӧ��
���� ���⿼���л�����ƶϣ�Ϊ��Ƶ���㣬�����л�������������ʵĹ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ת���й����ŵı仯����Ŀ�ѶȲ���

| A�� | 0.1 mol•L-1NH4Cl��Һ��KW����0.01mol?L-1NH4Cl��Һ��KW | |
| B�� | ����ͭ����Ʒ�Ʋ����������Ʒ������ǰ���������� | |
| C�� | N2��g��+3H2��g��?2NH3��g����H��0��������������ʱ�������¶ȣ���Ӧ����v��H2����H2��ƽ��ת���ʦ���H2�������� | |
| D�� | ˮ�����ӻ�����Kw �����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȷ�Ӧ |
| �����Լ� | ���� | |
| ���飨��ϩ�� | ��ˮ | ϴ�� |
| �����ƾ��� | ˮ | ��Һ |
| �ֱ�������ᴿ | ˮ | �ؽᾧ |

��֪����Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի����
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�����±�
| 20�� | 60�� | 100�� | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[��Դ��] | 183 | 269 | 415 |
��2����������H2SO4�����ƽ�⣺2CrO42-+2H+?Cr2O72-+H2O ����˵����Ӧ����ƽ��״̬����AD��
A����Һ��pHֵ���ֲ��� B��������Cr2O72-��=2������CrO42-��
C��CrO42- ��Cr2O72-��Ũ�ȱ�ֵ���ֲ��� D����Һ��ɫ���ֲ���
��3����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42-��8/9ת��ΪCr2O72-��
��ת����������Һ��c��Cr2O72-��=0.2mol•L-1��
����֪��T��ʱ�÷�Ӧ��ƽ�ⳣ��K=2��1013������ת����������Һ��pHΪ6.4����lg2=0.3 lg3=0.48 1g7=0.85��
��4����Na2Cr2O7��H2SO4���Һ�м���H2O2���ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5��������Ӧ�Ļ�ѧ����ʽΪ��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
 ���ߵĵ���ʽ��
���ߵĵ���ʽ�� ��
�� I����֪H2��g����CO��g����CH3OH��l���ı�ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJ•mol-1��
I����֪H2��g����CO��g����CH3OH��l���ı�ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ•mol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJ•mol-1��