题目内容
【题目】
(1)下列描述正确的是 (填写序号)
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸以皿、泥三角、三脚架、酒精灯 |
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可除去Fe2+ |
E.检验Na2SO3固体是否被氧化:
试样![]() 沉淀不溶解
沉淀不溶解
(2)某兴超小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
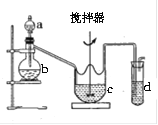
①b中反应的离子方程式为 ,c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清,此浑浊物是 (写物质名称)
③d中的试剂为 。
④为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是 。
【答案】(1)BD
(2)①![]()
![]() 的混合液 ②硫③NaOH溶液
的混合液 ②硫③NaOH溶液
④若SO2过量,溶液显酸性,产物分解:![]()
【解析】试题分析:(1)浓硝酸见光易分解,所以保存在棕色试剂瓶中,故A错误;B.容量瓶、分液漏斗在使用时需要检验是否漏水,故B正确;灼烧固体时需要用到的仪器有玻璃棒、坩埚、泥三角、三脚架、酒精灯,故C错误;Cl2或H2O2均可把Fe2+氧化为Fe3+,故D正确。(2)①b中用亚硫酸钠和硫酸反应制取SO2, 离子方程式为![]() ;根据反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,c中试剂为
;根据反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,c中试剂为![]() 的混合液;②反应开始后,c中先有浑浊产生,方程式为
的混合液;②反应开始后,c中先有浑浊产生,方程式为![]() ,浑浊物是硫;③为吸收二氧化硫,d中的试剂为氢氧化钠溶液;④若SO2过量,溶液显酸性,产物分解:
,浑浊物是硫;③为吸收二氧化硫,d中的试剂为氢氧化钠溶液;④若SO2过量,溶液显酸性,产物分解:![]() ,为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量。
,为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液, 滴定时左手旋转 的玻璃活塞,右手不停地摇动 ,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 4.20 | 25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。