题目内容
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质是 。
①硫酸氢钠固体 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡 ⑥氨气 ⑦冰醋酸
(2)写出下列物质在水中的电离方程式:碳酸: 。次氯酸钠: 。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为 。
(5)NO2与NO之间存在如下可逆反应:2NO2![]() 2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤![]() 的比值不再改变的状态
的比值不再改变的状态
【答案】(1)⑦;④⑥ (2)H2CO3![]() H++HCO3﹣;NaClO═ClO﹣+Na+
H++HCO3﹣;NaClO═ClO﹣+Na+
(3)小于 (4) 丙>甲=乙 (5) ①③④⑤
【解析】
试题分析:(1)存在电离平衡的电解质是弱电解质,醋酸是弱酸,属于电解质;溶于水和在熔融状态下均不能自身电离出离子的化合物是非电解质,蔗糖和氨气均是非电解质;
(2)碳酸是二元弱酸,电离方程式为H2CO3![]() H++HCO3﹣;次氯酸钠是强电解质,电离方程式为NaClO═ClO﹣+Na+。
H++HCO3﹣;次氯酸钠是强电解质,电离方程式为NaClO═ClO﹣+Na+。
(3)弱电解质的浓度越小,电离程度越大,甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,甲中一水合氨的电离程度小于乙中,则c(OH﹣)甲:c(OH﹣)乙小于10。
(4)酸和碱抑制水的电离,且氢离子和氢氧根浓度相等时抑制程度相等,醋酸是弱酸,溶液中氢离子浓度小于醋酸分子的浓度,因此甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为丙>甲=乙。
(5)①混合气体的颜色不再改变,说明NO2的浓度不再发生变化,反应达到平衡状态,正确;②容积和混合气体的中始终不变,则混合气体的密度始终不变,不能说明反应是否达到平衡状态,错误;③正反应是体积增大的可逆反应,当混合气体的压强不再改变的状态说明反应达到平衡状态,正确;④混合气体的质量不变,但物质的量变化,因此混合气体的平均相对分子质量是变化的,当不再改变时,说明反应达到平衡状态,正确;⑤![]() 的比值表示平衡常数的倒数,温度不变,平衡常数不变,比值始终不变,不能说明反应达到平衡状态,错误,答案选①③④⑤。
的比值表示平衡常数的倒数,温度不变,平衡常数不变,比值始终不变,不能说明反应达到平衡状态,错误,答案选①③④⑤。

【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.

(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和 溶液 |
|
C | 石棉绒与 | 与CO2反应,产生O2 |
D |
|
|
(2)为了达到实验目的, (填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;
(3)试管F中收集满气体后,下一步实验操作是:
【题目】
(1)下列描述正确的是 (填写序号)
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸以皿、泥三角、三脚架、酒精灯 |
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可除去Fe2+ |
E.检验Na2SO3固体是否被氧化:
试样![]() 沉淀不溶解
沉淀不溶解
(2)某兴超小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
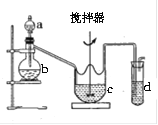
①b中反应的离子方程式为 ,c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清,此浑浊物是 (写物质名称)
③d中的试剂为 。
④为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是 。