题目内容
【题目】钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:

关于反应I、Ⅱ的下列说法中正确的是
A. 反应I中的TiO2是氧化剂
B. TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂
C. a=b=c=2
D. 每生成9.6 g Ti,反应I、Ⅱ中共转移0.8 mol电子
【答案】B
【解析】试题分析:A、TiO2中的两种元素都没变价,A错误;B、反应I中氯元素化合价由0价降到-1价,TiCl4在反应I中是还原产物,反应Ⅱ中Ti化合价由+4降到0价,是氧化剂,B正确;C、根据得失电子守恒配平方程式,a=1,b=c=2,C错误;D、9.6 g Ti物质的量0.2mol,反应I、Ⅱ中共转移1.6 mol电子,D错误。答案选B。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.

(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和 溶液 |
|
C | 石棉绒与 | 与CO2反应,产生O2 |
D |
|
|
(2)为了达到实验目的, (填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;
(3)试管F中收集满气体后,下一步实验操作是:
【题目】
(1)下列描述正确的是 (填写序号)
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸以皿、泥三角、三脚架、酒精灯 |
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可除去Fe2+ |
E.检验Na2SO3固体是否被氧化:
试样![]() 沉淀不溶解
沉淀不溶解
(2)某兴超小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
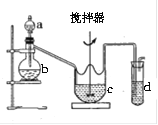
①b中反应的离子方程式为 ,c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清,此浑浊物是 (写物质名称)
③d中的试剂为 。
④为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是 。


