题目内容
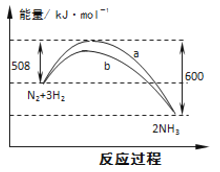
【题目】科学家正在研究利用催化技术将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO (g)![]() 2CO2(g)+N2(g) △H.
2CO2(g)+N2(g) △H.
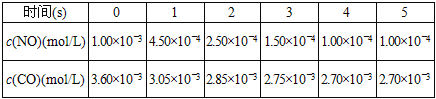
为了测定在某种催化剂作用下的反应速度,某温度下,在容积固体的容器内进行此反应,并用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在该反应的平衡常数的表达式K=________________。
(2)该反应在此温度下能够自发进行,说明△H___________0(填写“>”、“<”、“=”)。
若只将反应条件改为绝热,平衡时NO的浓度将___________(填“增大”、“减小”、“不变”)
(3)前2s内的平均反应速率v(N2)__________________.
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
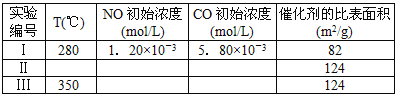
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,参考实验I实验条件下混合气体中NO浓度随时间变化的趋势曲线图,画出II、III条曲线图,并标明各条曲线的实验编号。

【答案】
(1)![]() ;
;
(2)<;增大
(3)1.875×10-4mol.L-1.s-1(或1.88×10-4mol.L-1.s-1);
(4)①II:280 ;1.20×10-3;5.80×10-3 ;III:1.20×10-3;5.80×10-3
②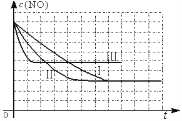
【解析】
试题分析:(1)根据2NO(g)+2CO (g)![]() 2CO2(g)+N2(g),该反应的平衡常数的表达式K=
2CO2(g)+N2(g),该反应的平衡常数的表达式K=![]() ,故答案为:
,故答案为:![]() ;
;
(2)该反应的△S<0,在此温度下能够自发进行,则△G=△H-T△S<0,说明△H<T△S <0,若只将反应条件改为绝热,随着反应的进行,容器内气体的温度升高,平衡逆向移动,平衡时NO的浓度将增大,故答案为:<;增大;
(3)前2s内的平均反应速度v(NO)=![]() =3.75×10-4mol/Ls:v(N2):v(NO)=1:2得到v(N2)=1.875×10-4mol/Ls,故答案为:1.875×10-4mol/Ls;
=3.75×10-4mol/Ls:v(N2):v(NO)=1:2得到v(N2)=1.875×10-4mol/Ls,故答案为:1.875×10-4mol/Ls;
(4)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;Ⅱ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,故答案为:II:280 ;1.20×10-3;5.80×10-3 ;III:1.20×10-3;5.80×10-3;
②因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅱ、Ⅲ的比表面积相同,温度不同,Ⅲ的温度高反应速率快,则Ⅲ先达到化学平衡,升高温度,平衡逆向移动,NO的平衡浓度大于Ⅱ,因此Ⅰ、Ⅱ、Ⅲ实验条件下混合气体中NO浓度随时间变化的趋势曲线图为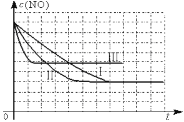 ,故答案为:
,故答案为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 + H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
【题目】
(1)下列描述正确的是 (填写序号)
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸以皿、泥三角、三脚架、酒精灯 |
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可除去Fe2+ |
E.检验Na2SO3固体是否被氧化:
试样![]() 沉淀不溶解
沉淀不溶解
(2)某兴超小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
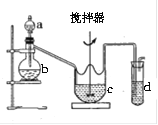
①b中反应的离子方程式为 ,c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清,此浑浊物是 (写物质名称)
③d中的试剂为 。
④为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是 。