题目内容
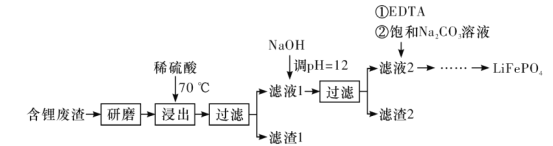
【题目】用含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
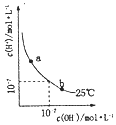
资料:i.滤液1、滤液2中部分离子的浓度(g·L-1):

ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物。
iii.某些物质的溶解度(S)如下表所示:
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是___。
(2)滤渣2的主要成分有___。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90°C下充分反应后,分离出固体Li2CO3粗品的操作是__。
(4)处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是__g。
II.纯化Li2CO3粗品
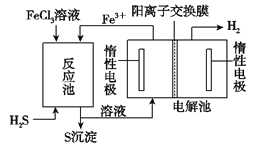
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是__,该池使用了__(填“阳”或“阴”)离子交换膜。

III.制备LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
【答案】研磨、70℃加热 Ni(OH)2、Mg(OH)2、Ca (OH)2 趁热过滤 185ab 4HCO3--4e-=4CO2↑+3O2↑+2H2O 阳 Li2CO3+2C+2FePO4![]() 2LiFePO4+3CO↑
2LiFePO4+3CO↑
【解析】
为加快含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)的酸浸速率,将其研磨粉碎,并用稀硫酸在70℃温度下溶浸,由于硫酸钙属于微溶物,经过滤,形成含有Li+、Ni2+、Mg2+、SO42-、少量Ca2+的滤液1,滤渣1中含有硫酸钙和不溶于硫酸的杂质,向滤液1中加入氢氧化钠,调节PH值为12,将Ni2+、Mg2+、少量Ca2+转化为Ni(OH)2、Mg(OH)2、Ca (OH)2,经过滤,得到主要含有Li+、SO42-和极少量Ni2+、Mg2+、Ca2+的滤液2,滤渣2中含有Ni(OH)2、Mg(OH)2、Ca (OH)2,向滤液2中加入EDTA将少量Ni2+、Mg2+、Ca2+转化为稳定的络合物,再加入饱和碳酸钠溶液将Li+转化为碳酸锂沉淀,并加热,趁热过滤,用热水洗涤分离出碳酸锂,再经过一系列操作最终制取正极材料LiFePO4,据此分析解答。
(1)根据分析和上述流程图示中为加快化学反应速率而采取的措施是研磨、70℃加热;
(2)根据分析和资料i,Ni、Mg、Ca在溶液中的浓度变化较大,滤渣2的主要成分含有Ni(OH)2、Mg(OH)2和Ca (OH)2;
(3)向滤液2中先加入EDTA,与Ni2+、Mg2+、Ca2+转化为稳定的络合物,从而确保它们不与Li+一起沉淀,再加入饱和Na2CO3溶液,90°C下充分反应后,形成碳酸锂的热饱和溶液,通过趁热过滤分离出固体碳酸锂的粗品;
(4) 处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,废渣中浸出锂的物质的量为![]() =
=![]() mol,转化为Li2CO3的锂的物质的量为
mol,转化为Li2CO3的锂的物质的量为![]() mol,根据锂元素守恒,则碳酸锂的物质的量为
mol,根据锂元素守恒,则碳酸锂的物质的量为![]() mol,则粗品中含Li2CO3的质量是
mol,则粗品中含Li2CO3的质量是![]() mol ×74g/mol=185abg;
mol ×74g/mol=185abg;
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液,HCO3-要参与电极反应转化为二氧化碳,才能制备高纯度的LiOH,根据电解原理,阳极发生氧化反应,且阳极的电极反应式是4HCO3--4e-=4CO2↑+3O2↑+2H2O;Li+移向阴极生成LiOH,该池使用了阳离子交换膜;
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,由质量守恒,可燃性气体应是一氧化碳,该反应的化学方程式是Li2CO3+2C+2FePO4![]() 2LiFePO4+3CO↑。
2LiFePO4+3CO↑。

【题目】研究![]() 、
、![]() 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:![]() 某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温
某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
| NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______ ![]() 保留两位小数
保留两位小数![]() .
.
②![]() 后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(2)用![]() 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①![]()
②![]()
③![]()
写出![]() 与
与![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 的热化学方程式 ______
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的![]() ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用![]() 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为 ______ ![]() 写出一种即可
写出一种即可![]() .
.
②若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈 ______ 性
恰好完全反应生成正盐,则此时溶液呈 ______ 性![]() 填“酸”或“碱”
填“酸”或“碱”![]() .
.![]() 已知常温下:氨水
已知常温下:氨水![]() ,
,![]()
![]() ,
,![]() .
.![]()
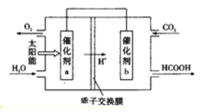
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图.催化剂b表面发生的电极反应式为 ______
的原理示意图.催化剂b表面发生的电极反应式为 ______ ![]() 常温下,
常温下,![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______ .
______ .