题目内容
16.有NH4HCO3和Na2CO3的混合溶液100mL,将它均分成两份,一份滴加0.1mol/L NaOH溶液200mL恰好反应完全,另一份滴加0.2mol/L H2SO4溶液150mL恰好反应完全,据此得知原混合溶液中c(Na+)为( )| A. | 2.5 mol/L | B. | 5 mol/L | C. | 1 mol/L | D. | 3 mol/L |
分析 NH4HCO3和Na2CO3的混合溶液加入NaOH,发生反应为:NH4HCO3+2NaOH═NH3•H20+Na2CO3+H2O;
另一份滴加0.2mol/L H2SO4溶液150mL的反应为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑,根据化学方程式计算解答.
解答 解:有NH4HCO3和Na2CO3的混合溶液100mL分成两等份,
设50ml溶液中含有NH4HCO3xmol,Na2CO3ymol,NH4HCO3和Na2CO3的混合溶液加入NaOH,反应为:
NH4HCO3+2NaOH═NH3•H20+Na2CO3+H2O,
1 2
x 0.1mol/L×0.2L
解得:x=0.01mol,则每份溶液中含有NH4HCO30.01mol;
加入0.2mol/L H2SO4溶液150mL的反应为:
2NH4HCO3 +H2SO4═(NH4)2SO4+CO2↑+H2O,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
2 1 1 1
0.01mol 0.005mol y 0.2mol/L×0.15L-0.05mol
解得:y=0.025mol,
n(Na+)=2n(Na2CO3)=0.05mol,
c(Na+)=$\frac{0.05mol}{0.05L}$=1mol/L,
故选C.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的化学反应,注意利用守恒思想进行的解答,侧重考查学生的思维能力、分析解决问题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列各组物质之间不可能实现如图所示转化的是 ( )


| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
1.一定条件下,2.3g钠与一定量氧气充分反应,得到3.5g固体(假设产物不发生化学反应),所得产物与足量水反应,产生的气体在标准状况下的体积为( )
| A. | 0.28L | B. | 0.56L | C. | 1.12L | D. | 2.24L |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
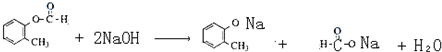
 C6H5COOCH3+H2O.
C6H5COOCH3+H2O.
 .
.